Cuando hablamos de átomos, entramos en un mundo fascinante y, a menudo, confuso. Desde los primeros pensadores de la antigüedad hasta los científicos modernos, el concepto de átomo ha evolucionado enormemente. Pero, ¿alguna vez te has preguntado cómo se han desarrollado los modelos atómicos a lo largo de la historia? En esta guía, vamos a explorar las semejanzas y diferencias entre los principales modelos atómicos, desde el modelo de Dalton hasta el modelo cuántico, desglosando cada uno de ellos y haciendo que todo sea más fácil de entender.
El Modelo de Dalton: La Base de Todo
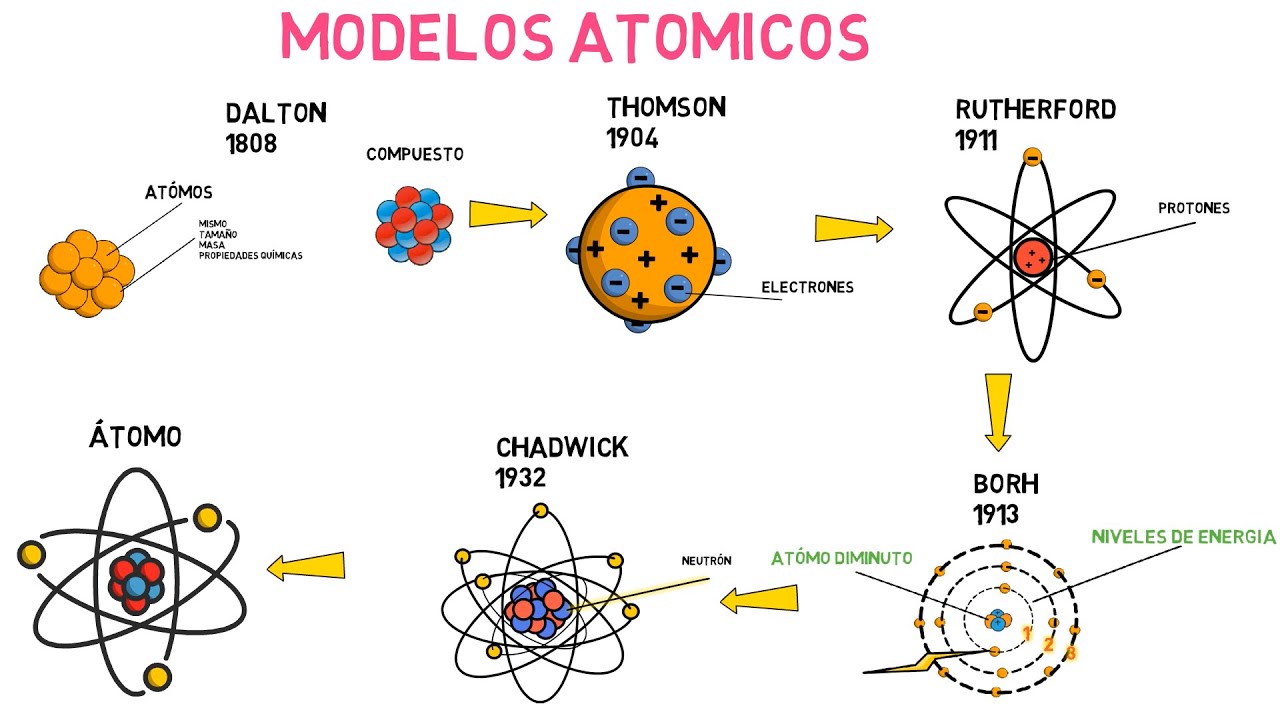
Empecemos con el modelo de John Dalton, que surgió a principios del siglo XIX. Dalton propuso que los átomos eran esferas pequeñas e indivisibles, como bolitas de billar. Imagina que tienes una bolsa de canicas; cada canica representa un átomo. Este modelo fue revolucionario porque introdujo la idea de que los elementos estaban formados por átomos específicos y distintos. Sin embargo, Dalton no tenía idea de que estos átomos eran, en realidad, mucho más complejos.
Características del Modelo de Dalton
- Los átomos son indivisibles y se combinan en proporciones fijas para formar compuestos.
- Cada elemento está formado por átomos idénticos, pero diferentes de los átomos de otros elementos.
- Las reacciones químicas implican la reorganización de los átomos.
Pero, ¿qué pasa si te digo que este modelo tenía fallos? Dalton no pudo explicar fenómenos como la electricidad y la radiactividad. Así que, a medida que la ciencia avanzaba, surgieron nuevos modelos que desafiaron sus ideas.
El Modelo de Thomson: La «Pudín de Ciruelas»
Luego llegó J.J. Thomson, quien, a finales del siglo XIX, descubrió el electrón. ¡Imagina el asombro! Thomson propuso un modelo que se parecía a un pudín de ciruelas, donde los electrones (las ciruelas) estaban incrustados en una «masa» positiva (el pudín). En este modelo, los átomos no eran esferas sólidas, sino más bien un «sopa» de carga positiva con electrones flotando en ella.
Diferencias con el Modelo de Dalton
Aquí es donde empieza a haber una gran diferencia. Mientras que Dalton veía a los átomos como indivisibles, Thomson abrió la puerta a la idea de que los átomos son en realidad compuestos por partículas subatómicas. Esto marcó un cambio crucial en la forma en que entendemos la materia.
El Modelo de Rutherford: Núcleo Denso
Avancemos un poco más en el tiempo. Ernest Rutherford, a principios del siglo XX, llevó la idea del átomo a un nuevo nivel. Después de realizar su famoso experimento de la lámina de oro, concluyó que los átomos tenían un núcleo denso y positivo, donde se concentraba la mayor parte de su masa. Imagina un pequeño sol en el centro de un sistema solar, con electrones orbitando a su alrededor.
Innovaciones en el Modelo de Rutherford
- El núcleo es pequeño pero muy denso, conteniendo protones y neutrones.
- Los electrones orbitan alrededor del núcleo en trayectorias definidas.
Pero, ¿qué pasa con la estabilidad de estos electrones? Aquí es donde el modelo de Rutherford también se queda corto. No pudo explicar por qué los electrones no colapsaban en el núcleo debido a la atracción electrostática.
El Modelo de Bohr: Órbitas Estables
Después de Rutherford, Niels Bohr introdujo un nuevo enfoque en 1913. Bohr propuso que los electrones se mueven en órbitas estables alrededor del núcleo, como planetas alrededor del sol. Además, sugirió que los electrones solo podían ocupar ciertas órbitas y que al saltar de una órbita a otra, podían emitir o absorber energía en forma de luz. ¡Un concepto brillante!
Las Ventajas del Modelo de Bohr
Este modelo fue un gran avance porque explicó muchas características del hidrógeno, el elemento más simple. Pero, aunque era útil, no podía explicar el comportamiento de átomos más complejos. Además, con el tiempo, los científicos se dieron cuenta de que el modelo de Bohr no era completamente preciso.
El Modelo Cuántico: La Complejidad de lo Subatómico
Finalmente, llegamos al modelo cuántico, que es donde realmente se pone interesante. A medida que la mecánica cuántica comenzó a desarrollarse, se hizo evidente que los electrones no se comportan como partículas simples. En lugar de eso, tienen propiedades tanto de partículas como de ondas. Imagina un mar en el que las olas representan la probabilidad de encontrar un electrón en un lugar determinado. Este modelo se basa en funciones de onda y orbitales, y es mucho más complejo que sus predecesores.
Características del Modelo Cuántico
- Los electrones no tienen órbitas fijas, sino que se describen mediante nubes de probabilidad.
- Los niveles de energía son discretos, pero la posición exacta de un electrón es incierta.
- Se basa en principios de la mecánica cuántica, como la dualidad onda-partícula.
Esto puede sonar un poco loco, pero es precisamente lo que la ciencia ha demostrado. Este modelo no solo explica el hidrógeno, sino que también se aplica a átomos más complejos, haciendo que nuestra comprensión de la materia sea mucho más rica.
Semejanzas y Diferencias: Un Resumen
Ahora que hemos explorado los distintos modelos atómicos, es hora de reflexionar sobre sus semejanzas y diferencias. Todos estos modelos intentan describir la naturaleza de los átomos, pero cada uno lo hace desde una perspectiva diferente. Mientras que el modelo de Dalton y el de Thomson se centraban en la idea de que los átomos eran más simples de lo que realmente son, Rutherford, Bohr y el modelo cuántico nos llevaron a una comprensión más profunda y compleja.
Comparación General
| Modelo | Descripción | Principales Contribuciones |
|---|---|---|
| Dalton | Átomo indivisible | Introducción del concepto de átomo como unidad básica. |
| Thomson | Pudín de ciruelas | Descubrimiento del electrón y la idea de carga positiva. |
| Rutherford | Núcleo denso | Descubrimiento del núcleo atómico y la estructura básica del átomo. |
| Bohr | Órbitas estables | Introducción de niveles de energía y órbitas definidas. |
| Cuántico | Probabilidad y nubes | Descripción de electrones como nubes de probabilidad y la dualidad onda-partícula. |
Como puedes ver, los modelos atómicos han evolucionado significativamente con el tiempo. Cada uno ha aportado algo valioso a nuestra comprensión de la materia, aunque también ha dejado preguntas sin respuesta. En este camino, hemos aprendido que el mundo subatómico es mucho más complejo y fascinante de lo que podríamos haber imaginado.
¿Por qué es importante estudiar los modelos atómicos?
Estudiar los modelos atómicos nos ayuda a entender la composición de la materia y los principios fundamentales de la química y la física. Nos permite conocer cómo interactúan los elementos y cómo se forman los compuestos.
¿Qué modelo atómico es el más aceptado hoy en día?
El modelo cuántico es el más aceptado en la actualidad, ya que proporciona una descripción más precisa y completa del comportamiento de los electrones en los átomos.
¿Los átomos son realmente indivisibles?
No, los átomos no son indivisibles. Están compuestos por partículas subatómicas: protones, neutrones y electrones. Además, los protones y neutrones están formados por quarks, lo que significa que la materia es aún más compleja de lo que pensamos.
¿Cómo se relacionan los modelos atómicos con la tecnología moderna?
Los modelos atómicos son fundamentales para el desarrollo de tecnologías como la electrónica, la medicina nuclear y los materiales avanzados. Sin una comprensión de la estructura atómica, muchas de las innovaciones tecnológicas que disfrutamos hoy en día no habrían sido posibles.
Este artículo explora en profundidad los modelos atómicos, sus semejanzas y diferencias, manteniendo un estilo conversacional y accesible para el lector. También incluye preguntas frecuentes que aportan más contexto y claridad sobre el tema.