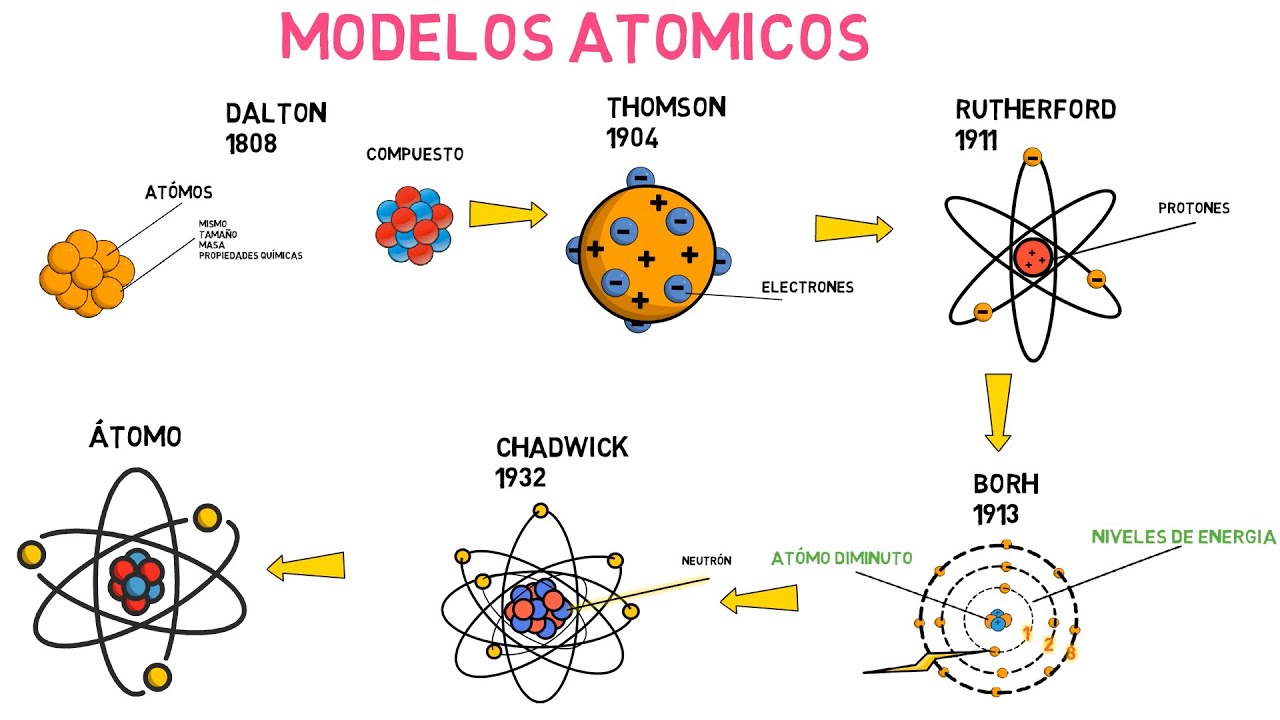
¿Alguna vez te has preguntado cómo llegamos a entender la materia que compone todo a nuestro alrededor? La historia del modelo atómico es un viaje fascinante a través de la ciencia, lleno de descubrimientos sorprendentes y cambios de paradigma. En este artículo, nos centraremos en uno de los personajes más influyentes en esta historia: J.J. Thomson. Su trabajo no solo revolucionó la forma en que concebimos el átomo, sino que también sentó las bases para futuros desarrollos en la física y la química. Así que, siéntate, relájate y acompáñame a explorar el legado de Thomson y su impacto en la ciencia moderna.
## La Búsqueda de la Naturaleza de la Materia
La búsqueda por entender la naturaleza de la materia ha sido una constante en la historia de la humanidad. Desde los filósofos griegos, como Demócrito, que propusieron la idea de que todo está compuesto por pequeñas partículas indivisibles, hasta los científicos del siglo XIX, la curiosidad humana ha empujado los límites del conocimiento. Pero, ¿qué sucedió en el medio? ¿Cómo pasamos de teorías filosóficas a modelos científicos concretos? Aquí es donde entra en juego J.J. Thomson.
### El Descubrimiento del Electrón
Thomson, un físico británico, realizó experimentos cruciales en 1897 que cambiaron el rumbo de la ciencia. Usando un tubo de rayos catódicos, descubrió que los rayos que se emitían eran en realidad partículas negativas, a las que llamó electrones. Imagina que estás en un espectáculo de fuegos artificiales, y de repente, en lugar de luces y colores, ves pequeñas chispas que brillan y se mueven de manera caótica. Así era el comportamiento de los electrones en el tubo. Este descubrimiento fue fundamental, ya que mostró que los átomos no son indivisibles, como se había pensado, sino que contienen partículas más pequeñas.
### La Teoría del «Pudín de Ciruelas»
Con su descubrimiento del electrón, Thomson propuso un nuevo modelo atómico, conocido como el modelo del «pudín de ciruelas». En este modelo, el átomo se visualizaba como una esfera positiva (el pudín) en la que estaban incrustadas las partículas negativas (las ciruelas). Este concepto fue revolucionario, ya que ofrecía una forma de entender cómo se organizan las partículas dentro de un átomo. Sin embargo, como veremos más adelante, este modelo no fue perfecto y fue objeto de revisiones posteriores.
## La Importancia de la Experiencia y el Método Científico
La historia de Thomson también subraya la importancia del método científico. Su enfoque basado en la experimentación y la observación empírica fue fundamental para validar sus hipótesis. En un mundo donde las teorías a menudo se aceptaban sin cuestionar, Thomson demostró que la ciencia avanza mediante la duda y la prueba. ¿Te imaginas un mundo donde no se cuestionaran las ideas? Sería un lugar estancado, ¿verdad?
### Experimentos que Cambiaron la Ciencia
Thomson no se detuvo en su primer descubrimiento. Realizó múltiples experimentos para entender mejor la naturaleza de los electrones y su relación con el átomo. Uno de sus experimentos más famosos fue la medición de la relación entre la carga y la masa del electrón. Este tipo de investigación es un excelente ejemplo de cómo la curiosidad puede llevar a descubrimientos significativos. ¿Quién no se ha sentido impulsado a desentrañar un misterio?
## La Competencia y el Desarrollo de Nuevas Teorías
A medida que avanzaba el siglo XX, otros científicos comenzaron a cuestionar y refinar el modelo de Thomson. Entre ellos, el famoso físico Ernest Rutherford. En 1909, Rutherford llevó a cabo su propio experimento con partículas alfa y oro, lo que llevó a la formulación de un nuevo modelo atómico que reemplazó al «pudín de ciruelas». Este modelo introdujo la idea de un núcleo denso y positivo en el centro del átomo, rodeado de electrones. ¿Cómo se siente saber que lo que una vez fue considerado la verdad absoluta puede ser desafiado y cambiado?
### La Evolución de la Teoría Atómica
El modelo de Rutherford fue un gran avance, pero aún había más por descubrir. Posteriormente, Niels Bohr propuso un modelo que incorporaba la cuantización de la energía de los electrones, lo que fue crucial para entender la estructura atómica. Esta evolución demuestra que la ciencia es un proceso continuo de revisión y mejora. Cada descubrimiento se basa en el anterior, como un castillo de naipes que se va construyendo capa por capa.
## Legado de J.J. Thomson
El legado de Thomson es innegable. Su trabajo no solo proporcionó un nuevo marco para entender la estructura atómica, sino que también abrió las puertas a la investigación en física de partículas y química cuántica. Hoy en día, el estudio de los electrones y sus interacciones es fundamental en campos como la electrónica y la nanotecnología. ¿No es asombroso pensar en cómo un solo descubrimiento puede influir en tantas áreas de la ciencia?
### La Ciencia y la Curiosidad Humana
Thomson también representa la esencia de la curiosidad humana. Su deseo de explorar lo desconocido y desafiar las creencias establecidas es algo que todos deberíamos llevar en nuestro interior. La ciencia no es solo un conjunto de hechos y fórmulas; es una forma de pensar, un enfoque para resolver problemas y entender el mundo que nos rodea. ¿Qué misterios aún nos quedan por descubrir?
## Conclusiones
En resumen, el proceso histórico del desarrollo del modelo atómico es una historia de descubrimientos, errores y evolución. Las aportaciones de J.J. Thomson fueron fundamentales para sentar las bases de lo que hoy conocemos sobre la materia. A través de su trabajo, nos enseñó que el conocimiento no es estático; siempre está en movimiento, siempre evolucionando. Así que la próxima vez que mires a tu alrededor, recuerda que todo lo que ves está compuesto por átomos, y esos átomos tienen una historia fascinante que contar.
### Preguntas Frecuentes
1. ¿Qué otros científicos contribuyeron al desarrollo del modelo atómico?
Además de J.J. Thomson, otros científicos clave incluyen a Ernest Rutherford, Niels Bohr, y más tarde, a científicos como Werner Heisenberg y Erwin Schrödinger, quienes desarrollaron la mecánica cuántica.
2. ¿Por qué el modelo del «pudín de ciruelas» fue descartado?
El modelo fue descartado porque no podía explicar ciertos fenómenos, como la dispersión de partículas alfa observada en el experimento de Rutherford, que mostró que los átomos tienen un núcleo denso.
3. ¿Qué importancia tienen los electrones en la química?
Los electrones son fundamentales en la química porque determinan la forma en que los átomos interactúan entre sí, formando enlaces químicos y estructuras moleculares.
4. ¿Cómo afecta el estudio del modelo atómico a la tecnología moderna?
El entendimiento de los átomos y electrones es crucial en el desarrollo de tecnologías como semiconductores, láseres y materiales avanzados, que son la base de muchos dispositivos electrónicos actuales.
5. ¿Qué lecciones podemos aprender de la historia del modelo atómico?
La historia del modelo atómico nos enseña la importancia de cuestionar lo que sabemos, la necesidad de la experimentación y el valor de la curiosidad científica en la búsqueda del conocimiento.