La historia de los modelos atómicos es un fascinante viaje a través del tiempo, donde la curiosidad humana y el deseo de entender el universo han llevado a los científicos a formular teorías cada vez más complejas y precisas sobre la materia. Desde la antigua Grecia, donde filósofos como Aristóteles sostenían que todo estaba compuesto por cuatro elementos: tierra, aire, fuego y agua, hasta los modernos modelos cuánticos que describen partículas subatómicas, el desarrollo del concepto de átomo ha sido un proceso lleno de descubrimientos y, a veces, de confusiones. A lo largo de este artículo, exploraremos las etapas clave en la evolución de los modelos atómicos y cómo cada uno ha contribuido a nuestro entendimiento actual de la materia.
Los Primeros Pensadores: Aristóteles y Demócrito
Para empezar, es esencial retroceder a la antigua Grecia, donde la filosofía se entrelazaba con la ciencia. Aristóteles, uno de los pensadores más influyentes de su tiempo, proponía una visión del mundo muy diferente a la de su contemporáneo, Demócrito. Mientras que Aristóteles creía en la existencia de los cuatro elementos, Demócrito introdujo la idea de que la materia estaba compuesta por pequeñas partículas indivisibles llamadas «átomos». Imagina que el átomo es como una pequeña esfera de boliche; aunque no puedes ver una esfera de boliche en el aire, sabes que está allí porque puedes ver las consecuencias de su impacto. Sin embargo, las ideas de Demócrito no fueron ampliamente aceptadas en su época, y la visión aristotélica prevaleció durante siglos.
La Dominancia de la Filosofía Aristotélica
Durante muchos años, la teoría de Aristóteles dominó el pensamiento científico. ¿Por qué? Porque sus ideas eran más accesibles y se alineaban con la observación cotidiana. La noción de cuatro elementos era fácil de entender; todos hemos visto fuego, agua y tierra. Sin embargo, esta perspectiva limitó el progreso en la comprensión de la materia. La falta de una explicación basada en partículas invisibles significó que la ciencia se estancara en gran medida. ¿Te imaginas vivir en un mundo donde las ideas de la ciencia no avanzan porque todos creen que la materia es simplemente una mezcla de elementos? Eso fue lo que ocurrió durante siglos.
El Renacimiento y el Surgimiento de la Química
Avancemos un poco en el tiempo, hasta el Renacimiento, un periodo de redescubrimiento y curiosidad intelectual. La alquimia, que mezclaba la química con la filosofía y la magia, comenzó a sentar las bases para el estudio más riguroso de la materia. Los alquimistas buscaban la piedra filosofal, un objeto mítico que supuestamente podía transformar metales en oro y otorgar la inmortalidad. Aunque sus métodos eran poco científicos, su búsqueda de la transformación de la materia fue un precursor vital para la química moderna.
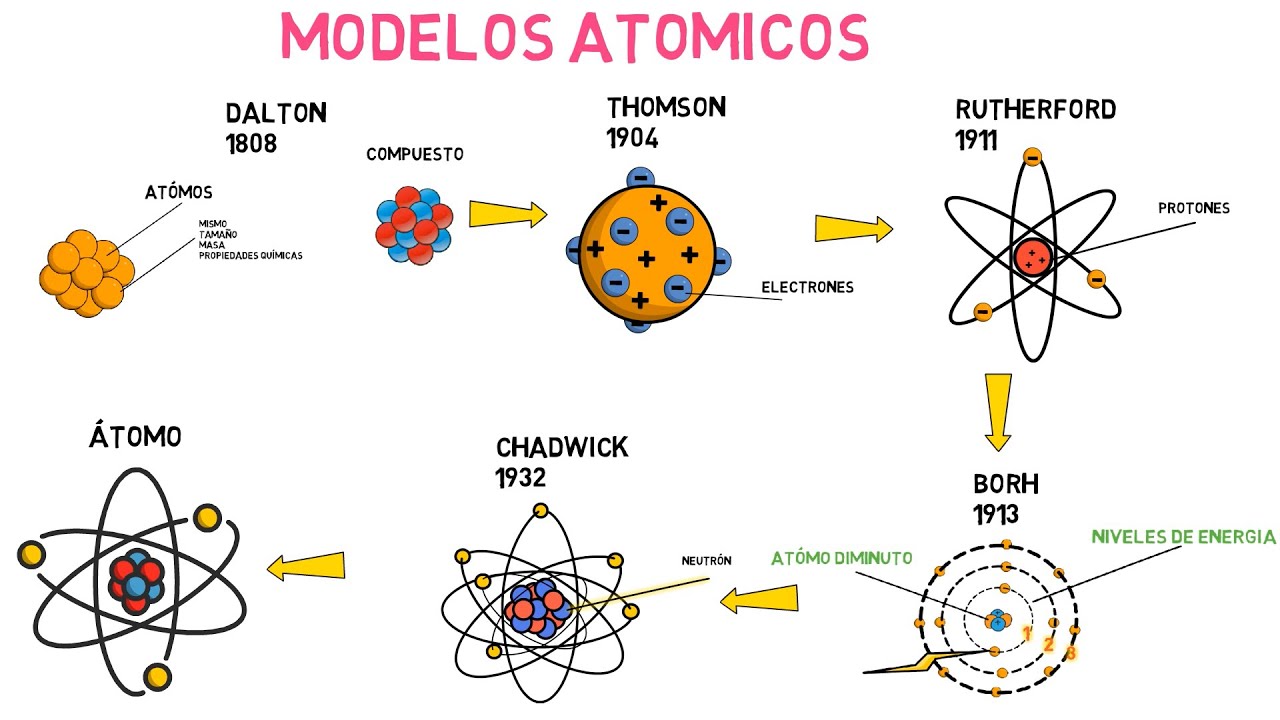
John Dalton y la Teoría Atómica Moderna
Finalmente, llegamos a John Dalton, un químico británico que, a principios del siglo XIX, revivió la idea de los átomos con un enfoque basado en la experimentación. Dalton propuso que cada elemento estaba compuesto por átomos de un tipo específico y que estos átomos eran indivisibles y esféricos, al igual que las canicas en una bolsa. ¡Eureka! Esta teoría sentó las bases para la química moderna. Imagina que cada tipo de átomo es como un jugador en un equipo de fútbol; cada uno tiene su propio rol y habilidades, pero todos trabajan juntos para formar una química perfecta.
Los Avances del Siglo XIX: Thomson y Rutherford
El siglo XIX fue testigo de una serie de avances significativos en la comprensión del átomo. J.J. Thomson, en 1897, descubrió el electrón, una pequeña partícula negativa que revolucionó la visión del átomo. Ahora, el átomo no era solo una esfera sólida, sino que contenía partículas más pequeñas. Imagínate que antes pensabas que tenías una pelota de fútbol, pero al abrirla, descubres que está llena de pequeñas pelotitas. Este descubrimiento llevó a Thomson a proponer el modelo del «pudín de pasas», donde los electrones estaban incrustados en una esfera de carga positiva, como las pasas en un pudín. Sin embargo, este modelo no duró mucho.
El Modelo Nuclear de Rutherford
En 1911, Ernest Rutherford llevó las cosas a un nuevo nivel con su famoso experimento de dispersión de partículas alfa. Al bombardear una fina lámina de oro con partículas alfa, observó que algunas de ellas se desviaban, lo que indicaba que había un núcleo denso y positivo en el centro del átomo. Esto era un gran cambio de juego. Imagina que el átomo es un sistema solar en miniatura: el núcleo es como el sol, mientras que los electrones giran a su alrededor como los planetas. Este modelo nuclear fue un gran paso hacia nuestra comprensión actual del átomo.
El Siglo XX y la Mecánica Cuántica
Con el avance de la ciencia, la mecánica cuántica comenzó a cambiar la forma en que pensamos sobre las partículas subatómicas. Niels Bohr, en 1913, introdujo su modelo atómico, que sugería que los electrones orbitan el núcleo en niveles de energía específicos, como los planetas que giran alrededor del sol. Pero aquí es donde las cosas se ponen un poco raras. En lugar de seguir trayectorias fijas, los electrones tienen probabilidades de estar en ciertos lugares. ¡Es como jugar a las escondidas! No sabes exactamente dónde está el electrón, pero sabes que tiene más posibilidades de estar en ciertos lugares que en otros.
El Principio de Incertidumbre de Heisenberg
La mecánica cuántica nos enseñó que no todo es predecible. Werner Heisenberg, en 1927, formuló su famoso principio de incertidumbre, que establece que no podemos conocer simultáneamente la posición y la velocidad de una partícula con precisión absoluta. Así que, si intentas observar un electrón, este se comportará de manera diferente. Es como intentar atrapar una mariposa con las manos; cuanto más intentes atraparla, más difícil se vuelve. Esta idea cambió radicalmente nuestra comprensión de la realidad y nos llevó a aceptar que, en el mundo cuántico, la incertidumbre es una parte fundamental.
Modelos Modernos: La Teoría Cuántica de Campos
Hoy en día, la teoría cuántica de campos es el modelo que mejor describe las interacciones fundamentales entre partículas. En este marco, las partículas no son solo objetos, sino excitaciones de campos que llenan todo el espacio. Imagina que el espacio es como un océano, y las partículas son olas que surgen y desaparecen en su superficie. Este modelo ha llevado a avances increíbles en la física, desde la comprensión de la materia oscura hasta la energía oscura, y continúa desafiando nuestras nociones de la realidad.
La Búsqueda de la Unificación de Fuerzas
A medida que exploramos más el universo, los científicos buscan unificar las fuerzas fundamentales de la naturaleza: la gravedad, el electromagnetismo y las fuerzas nucleares. La teoría de cuerdas y la gravedad cuántica son dos de las propuestas más intrigantes que intentan unir estos conceptos en un marco coherente. Imagínate un rompecabezas gigante donde cada pieza representa una fuerza o una partícula; la búsqueda de un modelo unificado es como encontrar la última pieza que completa la imagen. Sin embargo, aún estamos lejos de resolver este rompecabezas y entender completamente cómo funciona el universo a nivel fundamental.
La evolución de los modelos atómicos es un testimonio de la curiosidad humana y nuestra búsqueda incesante de conocimiento. Desde las ideas filosóficas de Aristóteles hasta los complejos modelos cuánticos de hoy, cada paso ha sido crucial para desentrañar los misterios de la materia. A medida que avanzamos, es emocionante pensar en cómo la ciencia seguirá desafiando nuestras percepciones y revelando nuevos secretos del universo.
- ¿Por qué Aristóteles no aceptó la teoría atómica de Demócrito? Aristóteles prefería explicaciones basadas en la observación de los elementos y su relación con el mundo natural, lo que lo llevó a rechazar la idea de átomos invisibles.
- ¿Qué impacto tuvo el descubrimiento del electrón en la química? El descubrimiento del electrón permitió a los científicos comprender mejor la estructura atómica y la formación de enlaces químicos, lo que revolucionó la química moderna.
- ¿Cómo afecta el principio de incertidumbre a la forma en que entendemos el universo? El principio de incertidumbre nos muestra que, en el mundo cuántico, la certeza absoluta es imposible, lo que desafía nuestras intuiciones sobre la realidad y la predicción.
- ¿Cuál es el objetivo de la teoría de cuerdas? La teoría de cuerdas busca unificar todas las fuerzas fundamentales de la naturaleza en un solo marco teórico, proporcionando una descripción más completa del universo.
- ¿Qué futuro nos espera en el estudio de la física atómica? Con el avance de la tecnología y nuevas teorías, el estudio de la física atómica seguramente revelará más secretos sobre la materia y la energía en el universo.
Este artículo ofrece una visión general de la evolución de los modelos atómicos, explorando las ideas de filósofos antiguos hasta los descubrimientos más recientes en la física moderna. Utiliza un estilo conversacional y preguntas retóricas para mantener el interés del lector, y concluye con una sección de preguntas frecuentes para abordar inquietudes comunes sobre el tema.