¿Alguna vez te has preguntado cómo funcionan las reacciones químicas a nivel atómico? El modelo de transferencia de electrones es una de las piezas clave en el rompecabezas de la química. Imagina que los electrones son como pequeños mensajeros que llevan información de un átomo a otro, facilitando la formación de enlaces y la transformación de sustancias. Este modelo no solo es crucial para entender la química básica, sino que también tiene aplicaciones en campos como la biología, la física y la ingeniería. En este artículo, vamos a desglosar este concepto fascinante, explorando sus fundamentos y aplicaciones prácticas. Así que, ¡prepárate para sumergirte en el mundo de los electrones!
¿Qué es la transferencia de electrones?
La transferencia de electrones es un proceso químico donde los electrones se mueven de un átomo o molécula a otro. Este fenómeno es fundamental en muchas reacciones químicas, especialmente en las reacciones redox, donde hay una transferencia de electrones entre dos especies químicas. Pero, ¿por qué es tan importante? Bueno, piensa en ello como una danza: cuando un electrón se mueve de un bailarín (átomo) a otro, se crea una nueva coreografía que puede dar lugar a nuevas sustancias. Este movimiento de electrones no solo cambia la estructura de los átomos involucrados, sino que también puede liberar o absorber energía, lo que a su vez puede influir en el entorno que los rodea.
Los fundamentos del modelo de transferencia de electrones
Para entender mejor la transferencia de electrones, es esencial conocer algunos conceptos básicos de la química. Cada átomo tiene electrones que orbitan alrededor de su núcleo, y estos electrones se organizan en capas o niveles de energía. Cuando los átomos interactúan, pueden compartir, donar o aceptar electrones. Este intercambio de electrones es lo que permite la formación de enlaces químicos y, en última instancia, la creación de nuevas moléculas.
Reacciones redox: el corazón de la transferencia de electrones
Las reacciones redox son el mejor ejemplo de transferencia de electrones. En una reacción redox, hay dos procesos que ocurren simultáneamente: la oxidación y la reducción. La oxidación se refiere a la pérdida de electrones, mientras que la reducción es la ganancia de electrones. Imagina que tienes una balanza: por cada electrón que se pierde en un lado, otro se gana en el otro. Esta balanza es crucial para mantener la estabilidad en los sistemas químicos.
Aplicaciones del modelo de transferencia de electrones
Ahora que hemos cubierto los fundamentos, es hora de explorar algunas aplicaciones prácticas del modelo de transferencia de electrones. Desde la generación de energía hasta la biología celular, este concepto juega un papel crucial en diversas áreas.
Generación de energía: celdas solares y baterías
Una de las aplicaciones más emocionantes del modelo de transferencia de electrones es en la generación de energía. Las celdas solares, por ejemplo, convierten la luz solar en electricidad a través de la transferencia de electrones. Cuando la luz solar incide sobre un material semiconductor, los electrones se excitan y comienzan a moverse, creando una corriente eléctrica. Es como si la luz estuviera dando un empujón a los electrones, llevándolos a una carrera para generar energía.
De manera similar, las baterías almacenan energía química que se libera a través de reacciones redox. Cuando conectas una batería a un dispositivo, los electrones fluyen desde el ánodo (donde ocurre la oxidación) hacia el cátodo (donde ocurre la reducción), proporcionando la energía necesaria para que tu dispositivo funcione. ¡Es como tener una pequeña central eléctrica en tu bolsillo!
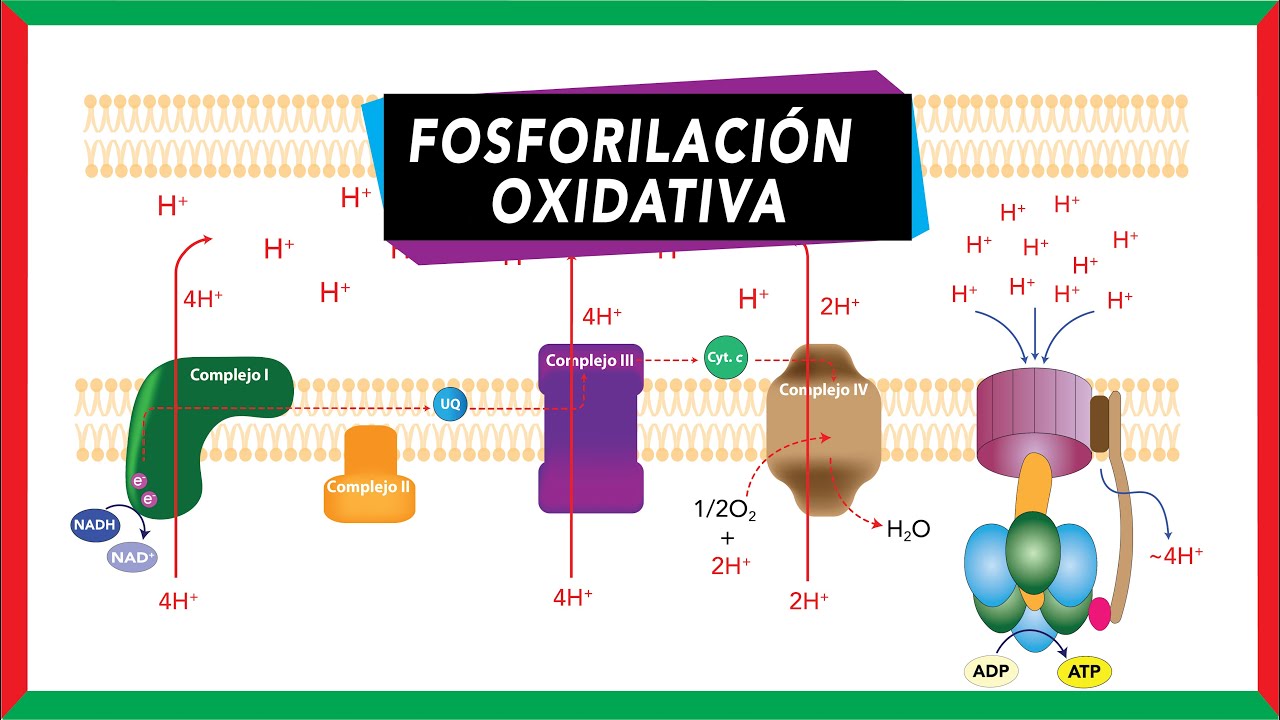
Biología celular: la respiración celular
En el mundo de la biología, la transferencia de electrones es fundamental para procesos vitales como la respiración celular. Durante este proceso, las células convierten la glucosa y el oxígeno en energía. La glucosa se oxida, lo que significa que pierde electrones, mientras que el oxígeno se reduce, ganando esos electrones. Este intercambio de electrones es lo que permite a nuestras células obtener la energía necesaria para funcionar. ¡Sin esta transferencia, no estaríamos aquí!
Desafíos y consideraciones
A pesar de las maravillas de la transferencia de electrones, también hay desafíos asociados. Uno de ellos es la eficiencia. En muchos procesos, una parte de la energía se pierde en forma de calor, lo que puede reducir la eficacia general. En el caso de las celdas solares, por ejemplo, los investigadores están constantemente buscando maneras de mejorar la eficiencia para aprovechar al máximo la luz solar.
Impacto ambiental
Otro aspecto a considerar es el impacto ambiental de las tecnologías basadas en la transferencia de electrones. Aunque las celdas solares y las baterías ofrecen soluciones más limpias en comparación con los combustibles fósiles, su producción y desecho también pueden tener efectos negativos. Es esencial que continuemos investigando y desarrollando tecnologías que minimicen estos impactos, asegurando un futuro más sostenible.
En resumen, el modelo de transferencia de electrones es un concepto fundamental que subyace en muchas reacciones químicas y procesos biológicos. Desde la generación de energía hasta la respiración celular, la transferencia de electrones está en el corazón de cómo funciona nuestro mundo. A medida que avanzamos hacia un futuro más sostenible, comprender y aplicar estos principios será crucial para resolver los desafíos que enfrentamos.
- ¿Qué es una reacción redox?
Una reacción redox es un proceso químico donde hay una transferencia de electrones entre dos especies, implicando oxidación y reducción. - ¿Cómo se relaciona la transferencia de electrones con la energía solar?
La energía solar se genera a través de la transferencia de electrones en materiales semiconductores que se excitan al recibir luz solar. - ¿Qué papel juega la transferencia de electrones en la respiración celular?
En la respiración celular, los electrones se transfieren de la glucosa al oxígeno, permitiendo la producción de energía en las células. - ¿Cuáles son los desafíos asociados con la transferencia de electrones en tecnología?
Los principales desafíos incluyen la eficiencia de los procesos y el impacto ambiental de la producción y desecho de tecnologías como baterías y celdas solares.