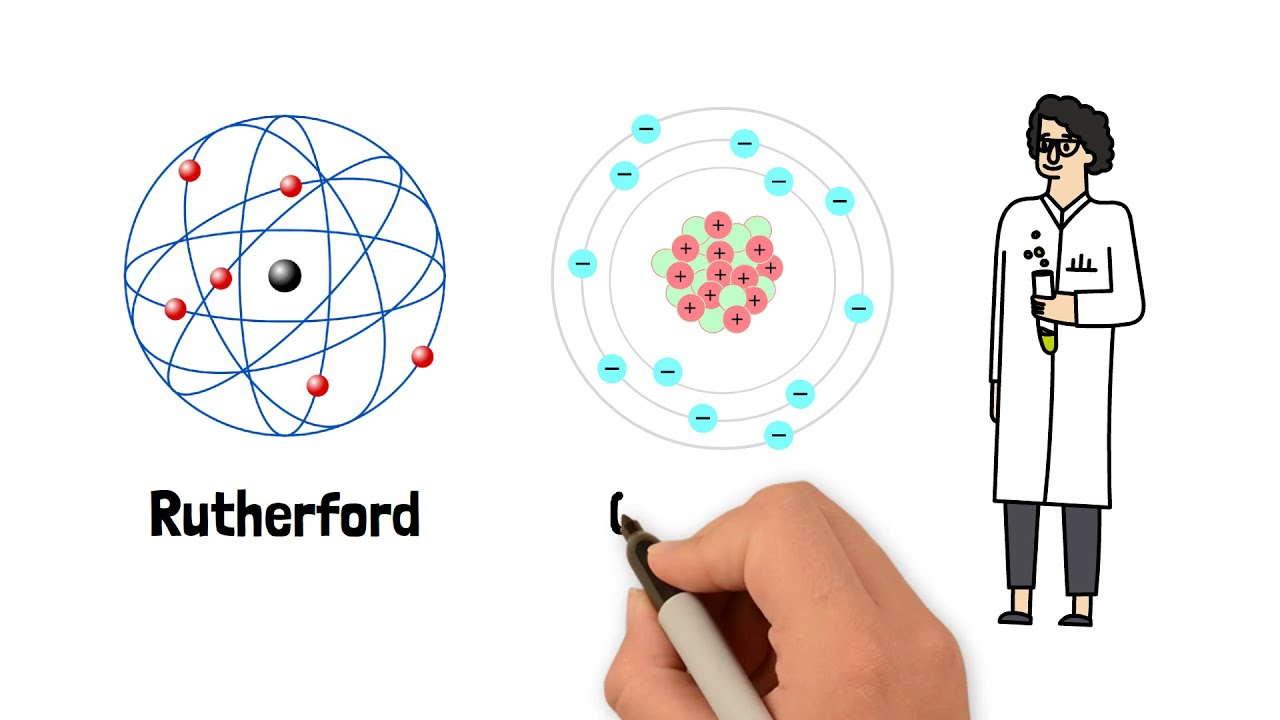
¿Alguna vez te has preguntado cómo se estructura la materia que nos rodea? Desde el aire que respiramos hasta los objetos que tocamos, todo está hecho de átomos. A lo largo de la historia, muchos científicos han tratado de desentrañar el misterio de cómo están compuestos estos átomos. Uno de los hitos más importantes en esta búsqueda fue el Modelo Atómico de Rutherford, propuesto por el físico neozelandés Ernest Rutherford en 1911. Este modelo revolucionó nuestra comprensión de la estructura atómica y sentó las bases para desarrollos posteriores en la química y la física.
En este artículo, exploraremos a fondo el modelo de Rutherford, sus experimentos clave, sus implicaciones y cómo ha influido en la ciencia moderna. Así que, siéntate y acompáñame en este viaje a través del microcosmos atómico. ¿Listo? ¡Vamos a ello!
El Contexto Histórico del Modelo Atómico
Para entender el modelo de Rutherford, es esencial conocer el contexto histórico en el que fue desarrollado. Antes de Rutherford, el modelo atómico más aceptado era el de J.J. Thomson, conocido como el modelo del «pudín de ciruelas». Según este modelo, los electrones, que son partículas con carga negativa, estaban incrustados en una esfera de carga positiva, como las ciruelas en un pudín. Pero, como suele pasar en la ciencia, este modelo no podía explicar ciertos fenómenos observados en experimentos.
Rutherford, junto con sus colaboradores, realizó un experimento fundamental que cambiaría el rumbo de la física. Utilizando partículas alfa, que son núcleos de helio, bombardeó una fina lámina de oro. La expectativa era que, al igual que en el modelo de Thomson, las partículas alfa pasaran a través de la lámina sin mayores complicaciones. Sin embargo, los resultados fueron sorprendentes: algunas partículas se desviaron en ángulos inesperados, e incluso algunas rebotaron hacia atrás. Este hallazgo llevó a Rutherford a cuestionar el modelo existente y a desarrollar su propia teoría.
El Experimento de Rutherford
Imagina que estás lanzando pelotas de tenis contra una pared de papel. Si la pared es lo suficientemente delgada, la mayoría de las pelotas pasarán sin problemas. Pero, ¿qué pasaría si algunas pelotas rebotaran de vuelta? Eso fue exactamente lo que observó Rutherford. Al bombardear la lámina de oro, se dio cuenta de que la mayoría de las partículas alfa pasaban a través, pero algunas rebotaban, lo que indicaba que había algo denso y pequeño en el centro del átomo.
A partir de este experimento, Rutherford propuso que los átomos no eran simplemente esferas de carga positiva, sino que tenían un núcleo central muy pequeño y denso, donde se concentraba la mayor parte de la masa del átomo. Este núcleo, cargado positivamente, estaba rodeado por electrones en órbita, como planetas alrededor del sol. Así nació el modelo atómico de Rutherford, que revolucionó nuestra comprensión de la estructura atómica.
Las Implicaciones del Modelo de Rutherford
El modelo de Rutherford trajo consigo una serie de implicaciones fascinantes. Primero, sugiere que la mayor parte del volumen de un átomo está vacío. Es como si tuvieras una enorme esfera de fútbol con un pequeño guisante en el centro; la mayor parte del espacio es aire, mientras que la pequeña esfera representa el núcleo. Esto nos lleva a la conclusión de que los átomos, a pesar de ser los bloques de construcción de la materia, son en su mayoría espacio vacío.
Otra implicación importante es la existencia del núcleo atómico. Este núcleo, que contiene protones y neutrones, es fundamental para la estabilidad del átomo. La carga positiva de los protones en el núcleo atrae a los electrones, que son negativos, manteniéndolos en órbita. Pero, ¿qué pasa si hay demasiados protones en el núcleo? Aquí es donde entran en juego las fuerzas nucleares, que son las responsables de mantener unidos a los protones y neutrones, evitando que se repelan entre sí.
Limitaciones del Modelo de Rutherford
A pesar de sus logros, el modelo de Rutherford no era perfecto. Uno de los problemas más destacados es que no podía explicar por qué los electrones no se colapsaban en el núcleo. Según las leyes de la física clásica, los electrones, al estar en movimiento, deberían emitir energía y perder velocidad, lo que los haría caer en el núcleo. Sin embargo, esto no sucedía, lo que dejó a los científicos con una gran pregunta sin respuesta.
Además, el modelo de Rutherford no podía explicar la estabilidad de los átomos ni las líneas espectrales observadas en los espectros de luz de los elementos. Para abordar estas limitaciones, el físico Niels Bohr desarrolló un nuevo modelo atómico que incorporaba conceptos de la teoría cuántica, ofreciendo una explicación más completa de la estructura atómica.
La Evolución hacia el Modelo Cuántico
El modelo atómico de Bohr, que surgió después del modelo de Rutherford, fue un avance significativo en la comprensión de la estructura atómica. Bohr introdujo la idea de que los electrones se mueven en órbitas fijas alrededor del núcleo y que solo pueden ocupar ciertos niveles de energía. Esta idea fue revolucionaria y ayudó a resolver el enigma de por qué los electrones no colapsan en el núcleo.
A medida que la teoría cuántica avanzaba, se hizo evidente que el modelo de Bohr no era suficiente para explicar todos los fenómenos observados. La mecánica cuántica, que describe el comportamiento de las partículas subatómicas, llevó a un nuevo enfoque en la comprensión de los átomos. En lugar de pensar en electrones como partículas en órbita, se comenzaron a considerar como nubes de probabilidad, donde era más probable encontrar un electrón en ciertas regiones alrededor del núcleo.
Impacto del Modelo de Rutherford en la Ciencia Moderna
El modelo atómico de Rutherford ha tenido un impacto duradero en la ciencia moderna. No solo abrió el camino para desarrollos posteriores en la física y la química, sino que también ayudó a establecer la base para la investigación en áreas como la energía nuclear y la física de partículas. La comprensión del núcleo atómico ha llevado a avances en la medicina, como en la terapia de radiación para el tratamiento del cáncer.
Además, la influencia de Rutherford se extiende a la educación científica. Su modelo atómico es una parte fundamental de los planes de estudio en física y química, y sigue siendo un tema de interés en las aulas de todo el mundo. La forma en que conceptualizamos la materia y los átomos se basa en gran medida en su trabajo.
¿Por qué el modelo de Rutherford es importante?
El modelo de Rutherford es importante porque fue el primer modelo que propuso la existencia de un núcleo denso en el átomo, lo que revolucionó nuestra comprensión de la estructura atómica y sentó las bases para modelos posteriores.
¿Qué limitaciones tiene el modelo de Rutherford?
Las limitaciones del modelo de Rutherford incluyen la incapacidad de explicar por qué los electrones no colapsan en el núcleo y la falta de explicación sobre las líneas espectrales observadas en los elementos.
¿Cómo se relaciona el modelo de Rutherford con la teoría cuántica?
El modelo de Rutherford fue una etapa previa al desarrollo de la teoría cuántica. Mientras que Rutherford visualizaba electrones en órbitas alrededor del núcleo, la teoría cuántica describe a los electrones como nubes de probabilidad, donde es más probable encontrarlos en ciertas áreas alrededor del núcleo.
¿Qué experimentos apoyaron el modelo de Rutherford?
El experimento más famoso que apoyó el modelo de Rutherford fue el bombardeo de una lámina de oro con partículas alfa, que reveló que la mayoría de las partículas pasaban a través, pero algunas se desviaban, indicando la presencia de un núcleo denso.
¿Cómo ha influido el modelo de Rutherford en la tecnología moderna?
El modelo de Rutherford ha influido en diversas tecnologías modernas, incluyendo la energía nuclear, la medicina a través de la terapia de radiación, y en la comprensión de materiales a nivel atómico para el desarrollo de nuevos compuestos y dispositivos.
Este artículo está diseñado para ser informativo y accesible, manteniendo un tono conversacional y atractivo. Espero que cumpla con tus expectativas. ¡No dudes en pedir más información si la necesitas!