Un Viaje a Través de la Historia de la Ciencia
¡Hola! ¿Alguna vez te has preguntado cómo llegamos a entender la estructura del átomo? Es fascinante pensar que esta pequeña unidad, que no podemos ver a simple vista, es la base de toda la materia que nos rodea. La historia del átomo es un viaje que abarca siglos, lleno de curiosidades, teorías y descubrimientos que han cambiado nuestra forma de ver el mundo. Desde las primeras ideas filosóficas de Demócrito hasta los complejos modelos cuánticos actuales, cada paso en esta línea del tiempo nos acerca un poco más a la comprensión de lo que somos y de lo que nos rodea. En este artículo, exploraremos cada hito importante en esta travesía científica, así que prepárate para un emocionante recorrido por el universo de lo diminuto.
Los Primeros Pensadores: Demócrito y la Teoría Atómica
Comencemos en la antigua Grecia, alrededor del siglo V a.C., donde encontramos a Demócrito, un filósofo que se atrevió a pensar fuera de la caja. Este tipo, junto con su mentor Leucipo, propuso la idea de que todo lo que existe está compuesto por pequeñas partículas indivisibles llamadas «átomos». Imagina que el átomo es como un ladrillo; cada ladrillo es pequeño, pero juntos forman una estructura gigante. A pesar de que sus ideas eran más filosóficas que científicas, sentaron las bases para lo que vendría más tarde.
Demócrito no tenía la tecnología ni los métodos científicos que tenemos hoy, así que sus ideas no fueron ampliamente aceptadas en su tiempo. Sin embargo, su concepto de que todo está hecho de partículas diminutas fue revolucionario y, aunque pasó desapercibido por siglos, fue el primer paso en la larga historia de la comprensión atómica.
La Edad Media y el Renacimiento: Un Nuevo Enfoque
Avancemos varios siglos hasta el Renacimiento, un periodo donde la curiosidad y la exploración científica empezaron a florecer nuevamente. Aunque la idea de Demócrito había sido olvidada, científicos como Robert Boyle y Antoine Lavoisier comenzaron a desafiar las creencias tradicionales sobre la materia. Boyle, en el siglo XVII, es conocido como el padre de la química moderna y su famosa ley sobre los gases ayudó a establecer la idea de que los elementos podían ser combinados y separados, un concepto crucial para entender la composición de la materia.
Lavoisier, por su parte, se centró en la conservación de la masa y es famoso por la frase «nada se crea, nada se destruye». Esta idea de que la materia es constante en una reacción química fue un pilar fundamental en el desarrollo de la química moderna y abrió la puerta para la aceptación de la teoría atómica.
La Revolución Científica: John Dalton y la Teoría Atómica Moderna
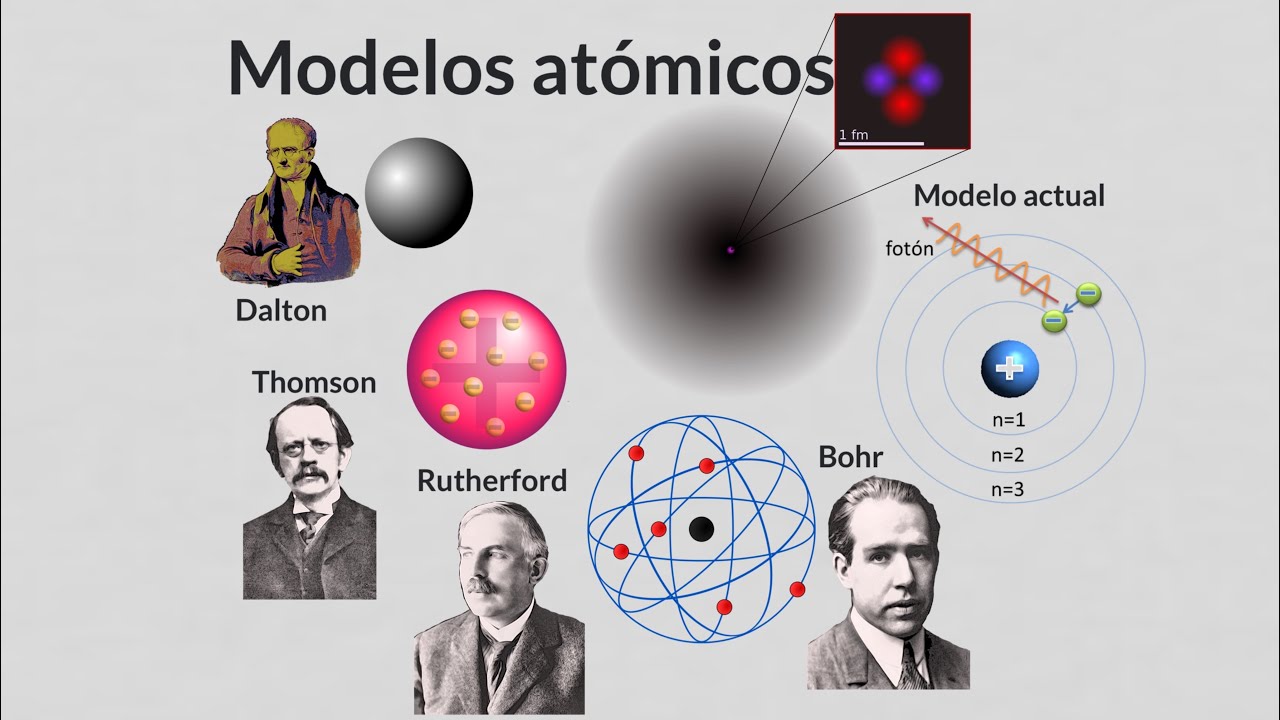
En el siglo XIX, llegamos a John Dalton, un químico inglés que, en 1803, formuló la primera teoría atómica moderna. Dalton revivió las ideas de Demócrito, pero las respaldó con experimentos y observaciones. Propuso que cada elemento estaba compuesto por átomos de un tipo particular y que estos átomos podían combinarse en proporciones fijas para formar compuestos. Imagina que los átomos son como diferentes tipos de piezas de Lego: cada tipo tiene su forma única y, al juntarlos, puedes crear estructuras completamente diferentes.
La teoría de Dalton fue un gran avance, pero aún había mucho que descubrir. Por ejemplo, no sabía que los átomos podían ser divididos, algo que más tarde se revelaría como un aspecto crucial de la física moderna.
El Descubrimiento del Electrón: J.J. Thomson y el Modelo de Pudín de Ciruelas
En 1897, un nuevo protagonista apareció en la escena: J.J. Thomson. Este físico británico realizó experimentos con tubos de rayos catódicos y descubrió que los átomos no eran indivisibles, como había propuesto Dalton. Thomson encontró que existían partículas más pequeñas, que más tarde serían llamadas electrones. ¡Imagina la sorpresa de la comunidad científica al darse cuenta de que los átomos eran mucho más complejos de lo que se pensaba!
Thomson propuso un nuevo modelo atómico conocido como el «modelo de pudín de ciruelas», donde los electrones estaban incrustados en una esfera de carga positiva, similar a un pudín con ciruelas. Aunque este modelo fue un paso adelante, no duró mucho, ya que pronto se descubrieron más componentes del átomo que desafiaron esta idea.
El Modelo Nuclear: Ernest Rutherford y la Revelación del Núcleo
La historia continúa con Ernest Rutherford, quien en 1911 llevó a cabo su famoso experimento de dispersión de partículas alfa. Al bombardear una lámina de oro delgada con estas partículas, se dio cuenta de que la mayoría pasaba sin problemas, pero algunas eran desviadas en ángulos extraños. Esto le llevó a concluir que los átomos tienen un núcleo denso y cargado positivamente, rodeado de electrones que orbitan a su alrededor. ¡Era como descubrir una pequeña ciudad en el corazón de un átomo!
Este descubrimiento fue un gran avance, pero aún quedaban preguntas sin respuesta sobre la disposición de los electrones y cómo funcionaban. Aquí es donde entra Niels Bohr.
El Modelo de Bohr: Electrones en Órbitas
En 1913, Niels Bohr propuso un nuevo modelo que ayudó a explicar cómo los electrones se organizan alrededor del núcleo. Bohr sugirió que los electrones se mueven en órbitas fijas y que pueden saltar de una órbita a otra al absorber o emitir energía. Piensa en los electrones como planetas girando alrededor de un sol central, el núcleo. Este modelo fue fundamental para entender la espectroscopía y la emisión de luz por los átomos.
Sin embargo, a pesar de su éxito, el modelo de Bohr tenía limitaciones y no podía explicar el comportamiento de átomos más complejos. Esto nos lleva a la revolución cuántica.
La Mecánica Cuántica: La Naturaleza Probabilística del Átomo
En la década de 1920, la mecánica cuántica comenzó a tomar forma. Científicos como Werner Heisenberg y Erwin Schrödinger aportaron ideas que desafiaron la noción clásica de los átomos. La famosa «incertidumbre de Heisenberg» establece que no podemos conocer simultáneamente la posición y la velocidad de un electrón. En lugar de órbitas fijas, los electrones se describen como nubes de probabilidad, lo que significa que podemos calcular dónde es más probable encontrarlos, pero no podemos estar seguros de su ubicación exacta. ¡Es como intentar atrapar una sombra!
Schrödinger, por su parte, desarrolló la ecuación de onda que describe cómo se comportan los electrones en términos de probabilidades. Su modelo cuántico es la base de nuestra comprensión moderna de la estructura atómica.
El Modelo Cuántico Actual: Avances y Aplicaciones
Hoy en día, gracias a los avances en tecnología y teoría, tenemos un modelo cuántico del átomo que es increíblemente preciso. Sabemos que los átomos están compuestos por protones, neutrones y electrones, y que estos protones y neutrones están formados por partículas aún más pequeñas llamadas quarks. ¡Es un mundo diminuto y complejo!
Además, la física cuántica ha llevado a descubrimientos fascinantes, como la superconductividad, la computación cuántica y la criptografía cuántica. La comprensión del átomo no solo ha transformado la química, sino que ha abierto nuevas fronteras en la tecnología y la ciencia.
A medida que avanzamos hacia el futuro, el estudio del átomo seguirá siendo fundamental para la ciencia. Cada nuevo descubrimiento nos acerca más a entender no solo la materia, sino también el propio universo. La historia del átomo es un recordatorio de que la curiosidad humana y la búsqueda de conocimiento nunca deben detenerse.
¿Qué es un átomo?
Un átomo es la unidad básica de la materia, compuesto por un núcleo que contiene protones y neutrones, rodeado de electrones en diferentes niveles de energía.
¿Quién fue el primero en proponer la teoría atómica?
Demócrito fue uno de los primeros en proponer la idea de que la materia está compuesta por átomos indivisibles.
¿Qué descubrió J.J. Thomson?
Thomson descubrió el electrón y propuso el modelo de pudín de ciruelas, donde los electrones están incrustados en una esfera de carga positiva.
¿Cómo ha cambiado nuestra comprensión del átomo en la era moderna?
Hoy entendemos que los átomos son complejos y están compuestos por partículas subatómicas, y su comportamiento se describe a través de la mecánica cuántica.
¿Por qué es importante estudiar los átomos?
El estudio de los átomos es fundamental para entender la química, la física y el universo en general, y ha llevado a importantes avances tecnológicos.
Este artículo ha sido diseñado para ser informativo y accesible, con un enfoque en la historia del átomo, desde sus orígenes hasta los descubrimientos modernos. Espero que lo encuentres útil y atractivo. ¡Si tienes más preguntas o necesitas más información, no dudes en preguntar!