La estructura atómica es como el mapa del tesoro de la materia. Si alguna vez te has preguntado qué hay en el corazón de los objetos que nos rodean, estás en el lugar correcto. Imagina que todo lo que ves, desde el aire que respiras hasta la silla en la que te sientas, está compuesto por diminutas partículas llamadas átomos. Pero, ¿qué son exactamente estos átomos? ¿Y cómo se organizan para formar todo lo que conocemos? En este artículo, nos adentraremos en el fascinante mundo de la estructura atómica, desglosando sus componentes y su importancia en la ciencia y en nuestra vida cotidiana.
¿Qué es un Átomo?
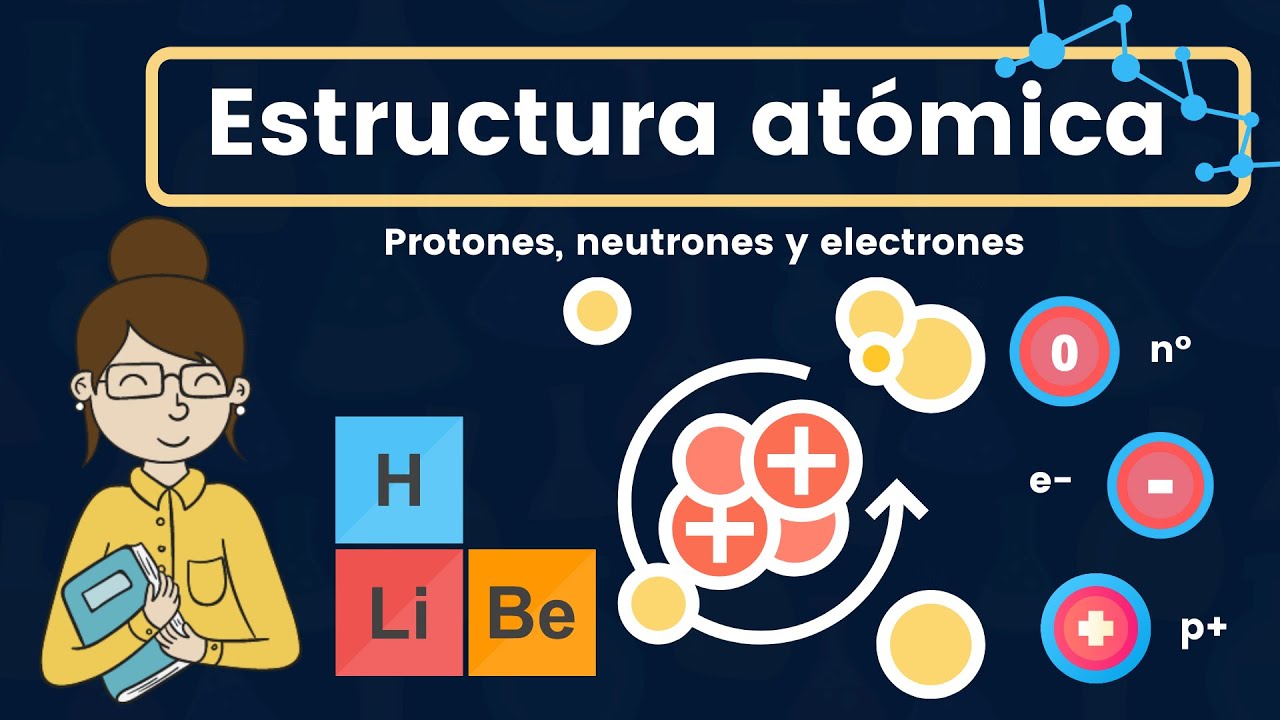
Un átomo es la unidad básica de la materia. Es como un pequeño sistema solar: en el centro se encuentra el núcleo, que es donde reside la mayor parte de la masa del átomo, y alrededor orbitan los electrones, similares a cómo los planetas giran alrededor del sol. Este núcleo está formado por protones y neutrones. Ahora, antes de que empieces a pensar que esto suena muy complicado, déjame explicarte cada parte de manera sencilla.
Componentes del Átomo
Primero, hablemos de los protones. Estos son partículas con carga positiva que se encuentran en el núcleo. Su número determina el elemento químico; por ejemplo, el hidrógeno tiene un solo protón, mientras que el carbono tiene seis. ¿No es fascinante pensar que el número de protones en un átomo puede cambiar todo sobre él?
Luego están los neutrones, que son partículas sin carga. Aunque no tienen carga, son esenciales porque ayudan a estabilizar el núcleo. Piensa en ellos como los mediadores en una discusión acalorada entre protones; sin ellos, los protones se repelerían debido a su carga positiva.
Por último, pero no menos importante, tenemos a los electrones. Estos son pequeños y ligeros, con carga negativa, y se mueven rápidamente alrededor del núcleo en lo que llamamos «nubes electrónicas». La forma en que se distribuyen los electrones determina cómo un átomo interactuará con otros átomos. ¡Es como si tuvieran su propio estilo de baile!
La Tabla Periódica: El Catálogo de los Elementos
La tabla periódica es como un gran bazar donde cada elemento tiene su propio puesto. ¿Alguna vez has visto cómo están organizados los puestos en un mercado? Cada uno tiene su lugar basado en ciertas características, y lo mismo ocurre con los elementos en la tabla periódica. Esta tabla no solo muestra los elementos, sino también sus propiedades y cómo se relacionan entre sí.
Organización de la Tabla Periódica
Los elementos están organizados en filas y columnas. Las filas se llaman períodos y las columnas se llaman grupos. Los elementos en el mismo grupo comparten propiedades similares. Por ejemplo, todos los metales alcalinos, que se encuentran en la primera columna, son altamente reactivos. Imagina que cada grupo de la tabla es como un club exclusivo donde todos los miembros comparten intereses similares.
Además, la tabla periódica también revela el número atómico de cada elemento, que es simplemente el número de protones en el núcleo. Es como la tarjeta de identificación de cada elemento, permitiéndonos saber quiénes son y qué pueden hacer.
Isótopos: Los Hermanos Gemelos del Átomo
Los isótopos son una versión interesante de los átomos. Imagina que tienes dos versiones de la misma canción, pero con un pequeño cambio en la letra. Eso es lo que son los isótopos: átomos del mismo elemento que tienen el mismo número de protones pero diferente número de neutrones. Esto significa que, aunque son del mismo «club», tienen propiedades físicas diferentes.
Aplicaciones de los Isótopos
Los isótopos tienen aplicaciones prácticas en muchos campos. Por ejemplo, el carbono-14 se utiliza en la datación de restos orgánicos. Es como un reloj que nos dice cuántos años tiene un fósil. Por otro lado, algunos isótopos radiactivos son utilizados en medicina para tratamientos de cáncer. ¿Ves cómo algo tan pequeño puede tener un impacto tan grande?
Enlaces Químicos: La Conexión entre Átomos
Los átomos no son solitarios; les encanta socializar. Se unen entre sí a través de enlaces químicos para formar moléculas. Imagina que cada átomo es una persona en una fiesta. Algunos son extrovertidos y se unen a muchos otros, mientras que otros prefieren mantener un grupo pequeño. Hay diferentes tipos de enlaces, y cada uno tiene su propio estilo de conexión.
Tipos de Enlaces Químicos
- Enlace iónico: Este tipo de enlace ocurre cuando un átomo cede electrones a otro. Es como un intercambio: uno da y el otro recibe. Esto resulta en la formación de iones cargados, que se atraen entre sí.
- Enlace covalente: Aquí, los átomos comparten electrones. Es como hacer un trato: ambos obtienen algo a cambio, y esta unión puede ser fuerte o débil dependiendo de cuántos electrones compartan.
- Enlace metálico: Este es un poco diferente. En este caso, los electrones son compartidos por un grupo de átomos, creando un «mar» de electrones que permite que los átomos se mantengan juntos. Esto es lo que le da a los metales su conductividad y maleabilidad.
La Importancia de la Estructura Atómica
Entender la estructura atómica no es solo un ejercicio académico; tiene implicaciones profundas en nuestra vida diaria. Desde la medicina hasta la tecnología, la forma en que los átomos interactúan y se combinan puede influir en todo, desde la creación de nuevos materiales hasta la producción de energía.
Aplicaciones Prácticas
En la medicina, por ejemplo, los avances en la comprensión de la estructura atómica han llevado a tratamientos más efectivos y diagnósticos más precisos. La resonancia magnética y la tomografía computarizada son tecnologías que dependen de principios atómicos. ¿Alguna vez te has preguntado cómo funcionan estas máquinas? Todo se reduce a cómo los átomos responden a diferentes tipos de energía.
En la tecnología, los semiconductores, que son fundamentales para dispositivos electrónicos, dependen de la manipulación de átomos para crear materiales que pueden conducir o bloquear la electricidad. Es un juego de estrategia a nivel atómico que permite que nuestros dispositivos funcionen.
- ¿Qué es un átomo? Un átomo es la unidad básica de la materia, compuesto por un núcleo con protones y neutrones, rodeado por electrones.
- ¿Qué son los isótopos? Son átomos del mismo elemento que tienen el mismo número de protones pero diferente número de neutrones.
- ¿Por qué son importantes los enlaces químicos? Los enlaces químicos permiten que los átomos se unan y formen moléculas, lo que es fundamental para la vida y la materia que nos rodea.
- ¿Cómo se relaciona la estructura atómica con la tecnología moderna? La comprensión de la estructura atómica ha permitido avances en medicina, electrónica y muchos otros campos, facilitando el desarrollo de nuevas tecnologías.
- ¿Cómo afecta la estructura atómica nuestra vida diaria? Desde los medicamentos que tomamos hasta los dispositivos electrónicos que usamos, la estructura atómica tiene un impacto en casi todos los aspectos de nuestra vida.
En conclusión, la estructura atómica es una maravilla de la naturaleza que nos ayuda a entender el mundo que nos rodea. Desde sus componentes hasta sus aplicaciones, cada pequeño detalle cuenta una historia fascinante. Así que la próxima vez que mires un objeto, recuerda que detrás de su apariencia hay un universo de átomos trabajando en armonía. ¿Te imaginas lo que más se puede descubrir en este pequeño pero poderoso mundo?