¿Por qué es importante entender la estructura cristalina?
La estructura cristalina de los elementos químicos es uno de esos temas que, aunque pueda sonar un poco técnico o incluso aburrido, es fundamental para comprender cómo funcionan las cosas en el mundo material que nos rodea. ¿Te has preguntado alguna vez por qué algunos metales son tan maleables y otros son tan duros? La respuesta a estas preguntas está profundamente relacionada con la forma en que los átomos se organizan en un cristal. En este artículo, exploraremos los diferentes tipos de estructuras cristalinas, sus propiedades y algunos ejemplos interesantes que te harán ver los elementos químicos de una manera completamente nueva. Así que, si estás listo, ¡comencemos este viaje fascinante por el mundo de los cristales!
¿Qué es una estructura cristalina?
Primero, aclaremos qué entendemos por estructura cristalina. En términos simples, una estructura cristalina es la disposición ordenada de átomos, iones o moléculas en un sólido. Imagina un edificio donde cada ladrillo está colocado en un lugar específico para formar una estructura fuerte y estable. De la misma manera, los átomos en un cristal se organizan en un patrón repetitivo que define su forma y propiedades. Esta organización no solo determina la apariencia del cristal, sino también sus características físicas y químicas, como la dureza, la conductividad eléctrica y térmica, e incluso su reactividad química.
Tipos de estructuras cristalinas
Existen varios tipos de estructuras cristalinas, cada una con sus propias características únicas. A continuación, analizaremos las más comunes:
Estructura cúbica
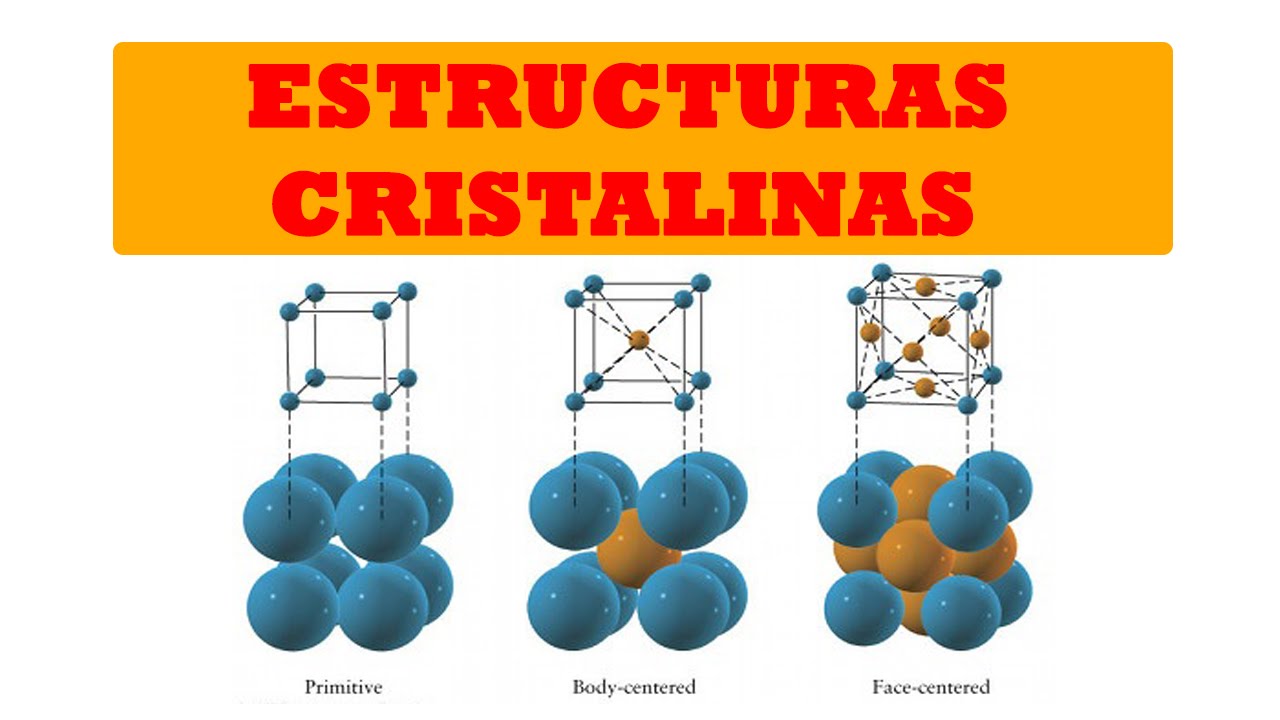
La estructura cúbica es quizás la más familiar. En esta disposición, los átomos están organizados en forma de cubo. Hay varios tipos de estructuras cúbicas, pero las más comunes son la cúbica simple, la cúbica centrada en el cuerpo (BCC) y la cúbica centrada en la cara (FCC). La estructura cúbica centrada en la cara, por ejemplo, se encuentra en metales como el oro y la plata, que son conocidos por su maleabilidad y ductilidad. Imagina un cubo de Rubik; si cada color representa un átomo, puedes visualizar cómo se agrupan en esta estructura.
Estructura hexagonal
La estructura hexagonal es otra forma común en la que los átomos se organizan. Aquí, los átomos se disponen en capas que se apilan en un patrón hexagonal. Este tipo de estructura se encuentra en metales como el magnesio y el titanio. Piensa en un panal de abejas; cada celda hexagonal representa un espacio ocupado por un átomo, y al igual que en el panal, hay una eficiencia en el uso del espacio.
Estructura ortorrómbica
La estructura ortorrómbica es un poco más compleja. En este caso, los átomos están organizados en un rectángulo tridimensional, lo que resulta en una forma que puede parecerse a un ladrillo. Esta estructura se encuentra en minerales como el yeso y algunos cristales de sal. Si alguna vez has visto ladrillos apilados en una pared, puedes imaginar cómo se organiza esta estructura.
Propiedades de las estructuras cristalinas
Las propiedades de las estructuras cristalinas son fascinantes y variadas. A continuación, exploraremos algunas de las más relevantes:
Dureza
La dureza de un material cristalino está fuertemente relacionada con su estructura. Por ejemplo, los cristales de diamante, que tienen una estructura cúbica de cara centrada, son extremadamente duros debido a la fuerte unión entre sus átomos de carbono. En contraste, los cristales de talco, que tienen una estructura laminar, son mucho más suaves y pueden ser fácilmente rayados. ¿Te imaginas cómo un simple cambio en la organización de los átomos puede influir en la resistencia de un material?
Conductividad eléctrica
La conductividad eléctrica también varía entre diferentes estructuras cristalinas. Los metales, que suelen tener estructuras cúbicas, son excelentes conductores de electricidad porque sus electrones están libres para moverse. Por otro lado, los aislantes, como el cuarzo, tienen una estructura que impide el flujo de electrones, lo que los convierte en malos conductores. Es como si los electrones estuvieran atrapados en una sala de espera, sin poder salir a la fiesta.
Transparencia y color
La forma en que la luz interactúa con los cristales también depende de su estructura. Los cristales de cuarzo son transparentes, mientras que otros, como el óxido de hierro, pueden tener colores vibrantes. Esto se debe a cómo los átomos absorben y reflejan la luz. Piensa en un prisma; dependiendo de cómo esté estructurado, puede descomponer la luz blanca en un arcoíris de colores.
Ejemplos de estructuras cristalinas en la naturaleza
Ahora que hemos cubierto los tipos y propiedades de las estructuras cristalinas, veamos algunos ejemplos fascinantes que se encuentran en la naturaleza.
Sal de mesa (NaCl)
La sal común, o cloruro de sodio, tiene una estructura cúbica. Cada átomo de sodio está rodeado por seis átomos de cloro, formando una red tridimensional. Esta organización no solo le da su sabor característico, sino que también determina su solubilidad en agua. Cuando agregas sal al agua, los enlaces entre los átomos se rompen y se dispersan, creando esa deliciosa mezcla que realza el sabor de tus comidas.
Grafito y diamante
Ambos son formas de carbono, pero sus propiedades son radicalmente diferentes debido a su estructura cristalina. El grafito tiene una estructura laminar que permite que las capas se deslicen unas sobre otras, lo que lo hace suave y perfecto para lápices. En cambio, el diamante, con su estructura cúbica, es uno de los materiales más duros conocidos. Es como si tuvieras dos caras de una misma moneda, cada una con características únicas debido a la forma en que los átomos están organizados.
Azufre (S8)
El azufre cristaliza en una estructura que forma anillos de ocho átomos. Esta disposición peculiar le da al azufre su color amarillo brillante y su olor característico. Imagina una cadena de eslabones; cada eslabón representa un átomo de azufre, y juntos forman una estructura que es tanto fuerte como flexible. Este ejemplo ilustra cómo la organización atómica puede influir en las propiedades físicas y químicas de un elemento.
Aplicaciones de las estructuras cristalinas
Las estructuras cristalinas no son solo un tema académico; tienen aplicaciones prácticas en la vida cotidiana y en diversas industrias.
Materiales en la construcción
Los materiales de construcción, como el cemento y los metales, se benefician enormemente de la comprensión de las estructuras cristalinas. La dureza y resistencia de estos materiales son esenciales para garantizar la seguridad y estabilidad de edificios y puentes. Por ejemplo, el acero, que tiene una estructura cúbica centrada en la cara, es un material clave en la construcción debido a su resistencia y durabilidad.
Electrónica
En el mundo de la electrónica, los semiconductores, que son fundamentales para dispositivos como teléfonos móviles y computadoras, dependen de estructuras cristalinas específicas. La silicio, por ejemplo, tiene una estructura cristalina que permite el control preciso del flujo de electricidad, lo que lo convierte en un material ideal para circuitos integrados. ¿Te imaginas cómo la disposición de unos pocos átomos puede influir en la tecnología que usas todos los días?
Medicina
En la medicina, los cristales también juegan un papel importante. Los fármacos a menudo se diseñan en forma de cristales para mejorar su solubilidad y biodisponibilidad. La estructura cristalina de un medicamento puede afectar su eficacia, lo que significa que los científicos deben prestar mucha atención a cómo se organizan los átomos en cada compuesto. Es como preparar una receta; cada ingrediente debe estar en la cantidad y forma correcta para obtener el resultado deseado.
En resumen, la estructura cristalina de los elementos químicos es un tema fascinante que nos ayuda a entender mejor el mundo material. Desde la dureza de un diamante hasta la maleabilidad del oro, la forma en que los átomos se organizan en un cristal influye en una variedad de propiedades físicas y químicas. Ya sea que estemos hablando de materiales de construcción, dispositivos electrónicos o medicamentos, la comprensión de las estructuras cristalinas es esencial para avanzar en la ciencia y la tecnología. Así que la próxima vez que veas un cristal, recuerda que hay mucho más de lo que parece a simple vista. ¡Los átomos están trabajando duro para darle forma a la materia!
¿Cómo se determina la estructura cristalina de un material?
La estructura cristalina de un material se puede determinar utilizando técnicas como la difracción de rayos X, que permite observar cómo se dispersan los rayos al pasar a través del cristal. Esta información se utiliza para construir un modelo de la disposición atómica.
¿Por qué algunos cristales son más frágiles que otros?
La fragilidad de un cristal depende de la fuerza de los enlaces entre sus átomos. En estructuras donde los átomos están fuertemente unidos, como en el diamante, el cristal es más duro. En cambio, en estructuras donde los enlaces son más débiles, como en el grafito, el cristal es más frágil.
¿Se pueden cambiar las propiedades de un cristal?
Sí, las propiedades de un cristal se pueden modificar mediante técnicas como la aleación, el tratamiento térmico o la aplicación de presión. Estos métodos pueden alterar la disposición atómica y, por lo tanto, cambiar las propiedades del material.
¿Qué papel juegan los cristales en la tecnología moderna?
Los cristales son fundamentales en la tecnología moderna, especialmente en la electrónica y las telecomunicaciones. Los semiconductores, que son esenciales para dispositivos electrónicos, dependen de estructuras cristalinas específicas para funcionar correctamente.
¿Cómo influyen las estructuras cristalinas en la vida cotidiana?
Las estructuras cristalinas influyen en muchos aspectos de nuestra vida cotidiana, desde los materiales de construcción hasta los alimentos que consumimos. Comprender cómo funcionan nos ayuda a apreciar mejor el mundo que nos rodea.