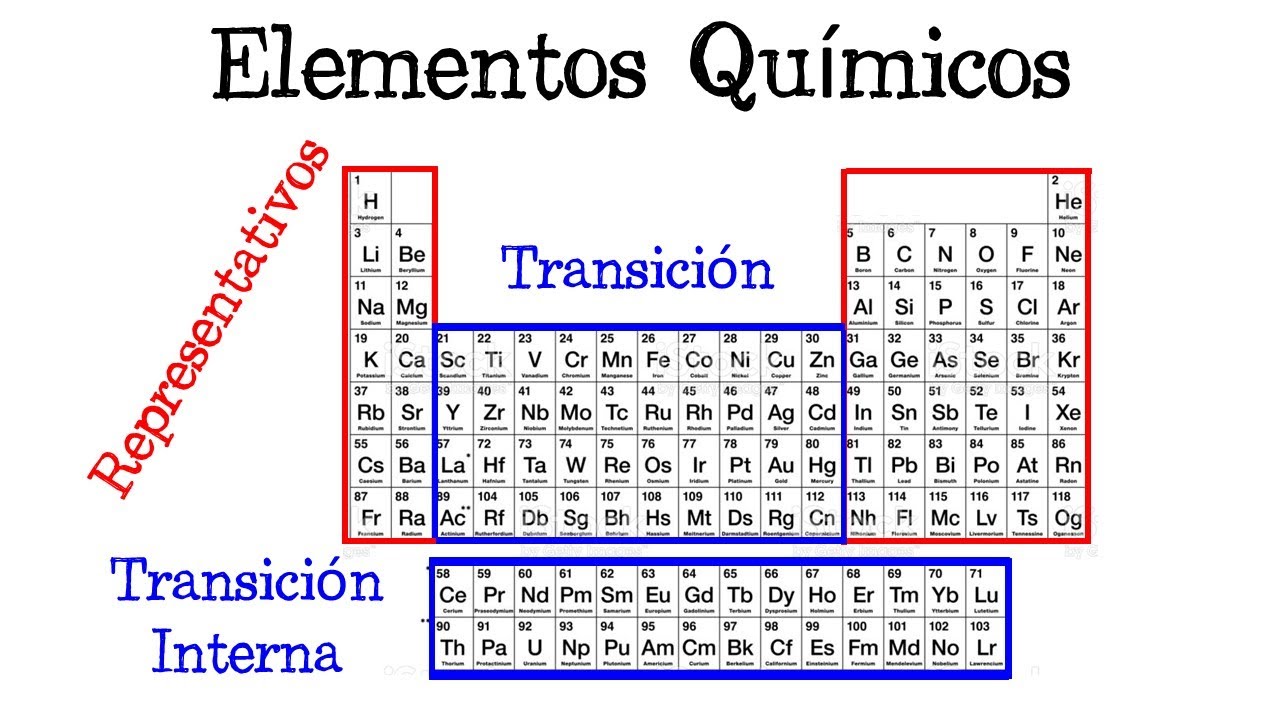
La tabla periódica es como un mapa del mundo de los elementos químicos. Cada elemento tiene su propia casilla, que revela no solo su identidad, sino también sus propiedades y relaciones con otros elementos. En este artículo, vamos a desglosar los elementos representativos, esos que a menudo vemos en las primeras filas de la tabla. ¿Te has preguntado alguna vez por qué ciertos elementos se agrupan juntos? O, ¿qué hace que algunos sean más reactivos que otros? Vamos a explorar su posición y características para que al final de este recorrido, te sientas como un verdadero experto en química.
Los elementos representativos son aquellos que pertenecen a los grupos 1, 2 y del 13 al 18 de la tabla periódica. Estos grupos son conocidos por tener propiedades químicas y físicas que son bastante consistentes. Por ejemplo, en el grupo 1 encontramos a los metales alcalinos, que son extremadamente reactivos, especialmente con el agua. Por otro lado, en el grupo 18, encontramos a los gases nobles, que son muy estables y rara vez reaccionan con otros elementos. ¿Curioso, verdad? Así que, si estás listo, vamos a profundizar en cada uno de estos grupos y descubrir qué los hace tan especiales.
Los Metales Alcalinos: Reactividad y Características
Los metales alcalinos son los elementos del grupo 1, que incluye al litio, sodio, potasio, rubidio, cesio y francio. Estos elementos son conocidos por su alta reactividad, especialmente con el agua. Imagina que estos metales son como adolescentes en una fiesta: siempre listos para saltar a la acción. Por ejemplo, cuando el sodio se encuentra con el agua, ocurre una reacción explosiva, generando hidrógeno y calor. ¡Es como una mini explosión!
Además de su reactividad, los metales alcalinos son muy blandos y pueden cortarse con un cuchillo. Esta característica es un indicativo de su baja densidad. Por ejemplo, el litio es tan ligero que flota en el agua. Si bien son muy útiles en diversas aplicaciones, como en baterías de teléfonos móviles y en la producción de aleaciones, su reactividad también significa que deben ser manipulados con cuidado. ¿Te imaginas tener un pedazo de sodio en tu bolsillo? No sería una buena idea.
El Grupo 2: Los Metales Alcalinotérreos
Siguiendo con nuestro recorrido, llegamos a los metales alcalinotérreos, que son los elementos del grupo 2: berilio, magnesio, calcio, estroncio, bario y radio. Aunque son menos reactivos que sus primos del grupo 1, no te dejes engañar; todavía tienen su cuota de sorpresas. Por ejemplo, el magnesio es un elemento clave en la industria y se utiliza en la fabricación de productos como aviones y fuegos artificiales. Cuando se quema, produce una luz brillante que puede ser deslumbrante.
Una característica interesante de los metales alcalinotérreos es que tienden a formar compuestos iónicos. Esto significa que cuando reaccionan con otros elementos, tienden a perder electrones y formar iones positivos. Por ejemplo, el calcio, cuando se combina con el oxígeno, forma óxido de calcio, que es fundamental en la construcción y en la producción de cemento. Así que, aunque no son tan explosivos como los metales alcalinos, definitivamente tienen un papel importante en nuestra vida diaria.
Elementos del Grupo 13: El Aluminio y sus Amigos
Ahora, pasemos al grupo 13, donde encontramos al famoso aluminio. Este metal es uno de los más utilizados en el mundo debido a su ligereza y resistencia a la corrosión. ¿Sabías que el aluminio es tan abundante en la corteza terrestre que representa aproximadamente el 8% de su peso? Este grupo también incluye al galio, indio y talio, pero el aluminio se lleva la mayor parte del protagonismo.
El aluminio es un gran ejemplo de cómo un elemento puede ser versátil. Se utiliza en todo, desde latas de refresco hasta aviones. Pero, ¿por qué es tan popular? Una de las razones es su capacidad para formar una capa de óxido en su superficie, lo que lo protege de la corrosión. Esto es como tener un escudo que lo protege de los ataques del ambiente. Sin embargo, el galio es curioso, ya que tiene un punto de fusión tan bajo que puede derretirse en la palma de tu mano. ¡Imagina tener un metal que se funde tan fácilmente!
El Grupo 14: El Carbono y sus Compañeros
El grupo 14 es conocido como el grupo del carbono, y aquí es donde las cosas se ponen realmente interesantes. El carbono es la base de la vida tal como la conocemos. Este elemento es único porque puede formar enlaces con otros átomos de carbono, creando cadenas largas y complejas que forman compuestos orgánicos. ¡Sin carbono, no tendríamos plantas, animales ni seres humanos!
Además del carbono, este grupo incluye al silicio, germanio, estaño y plomo. El silicio, por ejemplo, es fundamental en la industria de la tecnología, ya que se utiliza en la fabricación de semiconductores. ¿Alguna vez has oído hablar de la «Era del Silicio»? Es un término que se refiere al auge de la tecnología y la informática, y todo gracias a este elemento. Sin embargo, el plomo, aunque tiene aplicaciones útiles, es tóxico y debe ser manejado con cuidado. La lección aquí es que no todos los elementos del grupo son iguales; cada uno tiene su propio conjunto de características y aplicaciones.
Elementos del Grupo 15: Nitrógeno y sus Compañeros
En el grupo 15 encontramos al nitrógeno, que constituye aproximadamente el 78% de la atmósfera terrestre. Este gas es esencial para la vida, ya que es un componente clave de los aminoácidos, que son los bloques de construcción de las proteínas. Sin nitrógeno, las plantas no podrían crecer y, por ende, no tendríamos alimento. Es como el hilo invisible que conecta todo en el ciclo de la vida.
Además del nitrógeno, este grupo incluye al fósforo, arsénico, antimonio y bismuto. El fósforo es crucial para la producción de fertilizantes y es un elemento que se encuentra en todos los seres vivos. Sin embargo, el arsénico, aunque tiene aplicaciones en la medicina y la industria, es conocido por su toxicidad. Esto nos recuerda que, aunque los elementos pueden tener propiedades útiles, también pueden ser peligrosos si no se manejan adecuadamente.
El Grupo 16: Oxígeno y sus Propiedades
El oxígeno es quizás el elemento más famoso del grupo 16. Es esencial para la respiración de la mayoría de los organismos en la Tierra. Sin oxígeno, no podríamos vivir. Pero, ¿sabías que el oxígeno también puede ser un elemento reactivo? Cuando se combina con otros elementos, forma óxidos, que son compuestos importantes en la química y la biología. Además del oxígeno, este grupo incluye al azufre, selenio, telurio y polonio. El azufre, por ejemplo, es conocido por su olor a huevo podrido, pero también tiene aplicaciones en la producción de ácido sulfúrico, uno de los productos químicos más utilizados en la industria.
Elementos del Grupo 17: Halógenos, la Familia Reactiva
Los halógenos son los elementos del grupo 17, que incluyen al flúor, cloro, bromo, yodo y astato. Estos elementos son conocidos por su alta reactividad, especialmente con los metales, formando sales. El flúor es el elemento más reactivo de todos y se utiliza en la producción de pasta de dientes y en la fabricación de teflón. Por otro lado, el cloro se utiliza como desinfectante en el agua potable. Es como un superhéroe que elimina gérmenes, pero también puede ser peligroso si no se maneja adecuadamente.
El Grupo 18: Gases Nobles, los Elementos Estables
Finalmente, llegamos al grupo 18, conocido como los gases nobles. Este grupo incluye al helio, neón, argón, criptón, xenón y radón. Estos elementos son famosos por su estabilidad y baja reactividad. ¿Por qué? Porque tienen una capa de electrones completa, lo que significa que no necesitan interactuar con otros elementos. Son como los introvertidos de la tabla periódica, contentos en su propio espacio.
El helio, por ejemplo, es el segundo elemento más ligero y se utiliza en globos y en la refrigeración de imanes en resonancia magnética. El neón es conocido por su brillante luz en letreros de neón. Aunque no son muy reactivos, los gases nobles tienen aplicaciones importantes en la industria y la tecnología.
Ahora que hemos explorado los elementos representativos de la tabla periódica, es evidente que cada grupo tiene sus propias características y propiedades únicas. Desde la reactividad de los metales alcalinos hasta la estabilidad de los gases nobles, cada elemento juega un papel crucial en la química y en nuestras vidas diarias. La próxima vez que mires la tabla periódica, recuerda que detrás de cada casilla hay una historia que contar.
Entonces, ¿cuál es tu elemento favorito y por qué? ¿Hay algún elemento que te sorprenda más que otro? La química está en todas partes, y cada elemento tiene algo especial que ofrecer. Así que, mantén la curiosidad viva y sigue explorando el fascinante mundo de la química.
¿Qué son los elementos representativos?
Los elementos representativos son aquellos que se encuentran en los grupos 1, 2 y del 13 al 18 de la tabla periódica. Se caracterizan por tener propiedades químicas y físicas consistentes.
¿Por qué los metales alcalinos son tan reactivos?
Los metales alcalinos son altamente reactivos porque tienen un solo electrón en su capa externa, lo que los hace ansiosos por perderlo y formar enlaces con otros elementos.
¿Qué aplicaciones tiene el carbono en la vida diaria?
El carbono es fundamental para la vida, ya que forma la base de compuestos orgánicos. Se utiliza en plásticos, combustibles, alimentos y en la industria farmacéutica.
¿Por qué los gases nobles son considerados inertes?
Los gases nobles son considerados inertes porque tienen una capa de electrones completa, lo que les impide reaccionar fácilmente con otros elementos.
¿Cuál es el elemento más abundante en la Tierra?
El oxígeno es el elemento más abundante en la Tierra, representando aproximadamente el 46% de la corteza terrestre en peso.