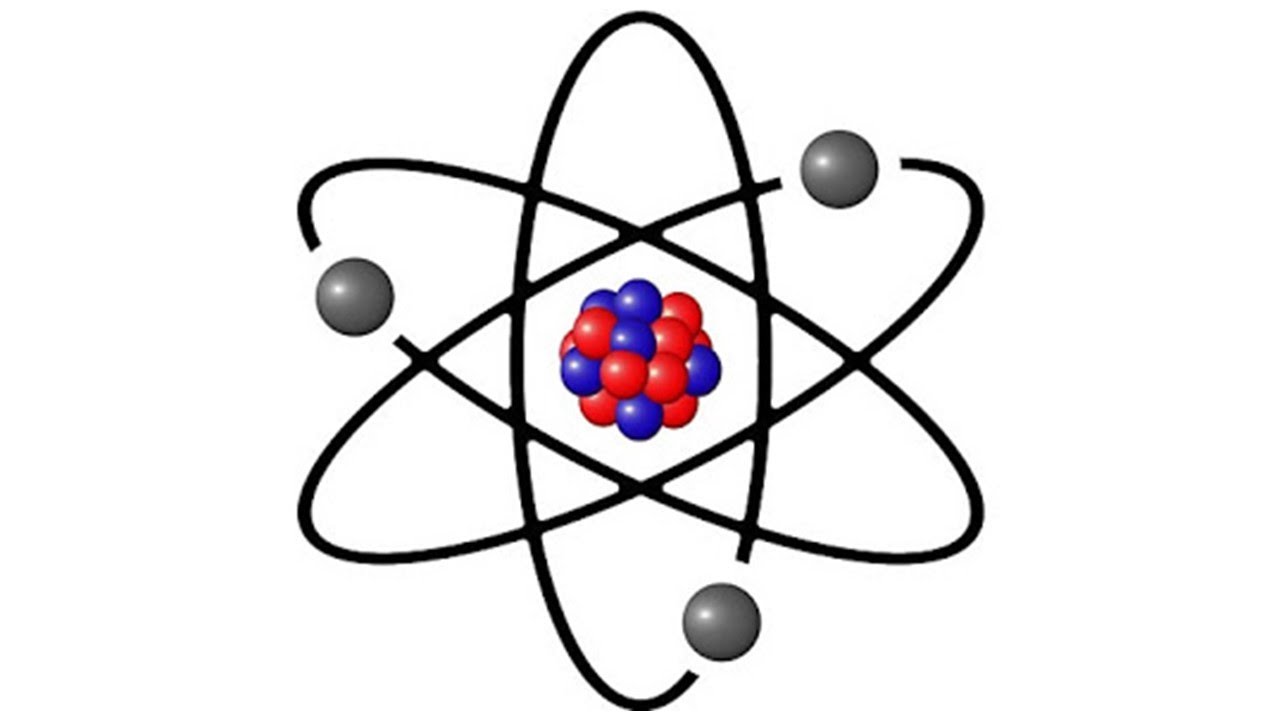
Explorando el Mundo Subatómico
¿Alguna vez te has preguntado qué hace que la materia sea materia? ¡Bienvenido al fascinante mundo de las partículas subatómicas! En este artículo, nos adentraremos en la vida de tres protagonistas esenciales: los electrones, protones y neutrones. Estas pequeñas entidades no solo son la base de todo lo que vemos a nuestro alrededor, sino que también juegan roles cruciales en la química y la física. Así que, si estás listo, ¡vamos a descubrir las diferencias y características de estas partículas!
## ¿Qué Son los Proton, Neutrones y Electrones?
Antes de entrar en detalles sobre sus diferencias, primero debemos entender qué son estos pequeños pero poderosos componentes. Los protones y neutrones residen en el núcleo de un átomo, mientras que los electrones orbitan alrededor de este núcleo, casi como planetas girando alrededor del sol. ¡Interesante, verdad? Pero, ¿cuál es el papel de cada uno en este gran teatro cósmico?
### Proton: El Rey del Núcleo
Los protones son partículas subatómicas con una carga positiva. Imagina que son como el rey de un castillo, estableciendo el orden en el reino atómico. Cada elemento en la tabla periódica se define por el número de protones que tiene. Por ejemplo, el hidrógeno tiene un solo protón, mientras que el oxígeno tiene ocho. Este número, conocido como el número atómico, determina las propiedades químicas del elemento. Pero, ¿qué pasaría si cambiamos el número de protones? ¡Ahí es donde las cosas se ponen realmente interesantes!
### Neutrones: Los Compañeros Silenciosos
Los neutrones, por otro lado, son partículas sin carga. Si los protones son el rey, los neutrones podrían ser considerados los consejeros sabios que ayudan a mantener la estabilidad del núcleo. Sin ellos, los protones se repelerían entre sí debido a sus cargas positivas. La combinación de protones y neutrones forma el núcleo del átomo, y su número combinado se llama número másico. ¿Sabías que los isótopos de un elemento son variantes que tienen el mismo número de protones pero diferente número de neutrones? ¡Así es, un pequeño cambio puede generar grandes diferencias!
### Electrones: Los Viajeros Inquietos
Por último, tenemos a los electrones, que son las partículas con carga negativa que orbitan alrededor del núcleo. Si imaginamos al núcleo como el sol, los electrones serían como los planetas que giran a su alrededor. Estos pequeños viajeros son fundamentales para la formación de enlaces químicos. La forma en que se organizan en capas o niveles de energía determina cómo un átomo interactuará con otros átomos. ¡Así que sí, estos diminutos electrones tienen un gran impacto en el mundo que nos rodea!
## Comparación de Cargas y Massas
Una de las diferencias más evidentes entre estas partículas es su carga y masa. Vamos a desglosar esto un poco más.
### Carga Eléctrica
– Protones: +1 (carga positiva)
– Neutrones: 0 (sin carga)
– Electrones: -1 (carga negativa)
Esta carga eléctrica es crucial para entender cómo interactúan las partículas entre sí. Por ejemplo, los protones y electrones se atraen mutuamente, mientras que los protones se repelen entre sí. Esto es lo que mantiene a los electrones en órbita alrededor del núcleo.
### Masa
Cuando hablamos de masa, los protones y neutrones son bastante similares y significativamente más pesados que los electrones. Un protón o un neutrón tiene una masa aproximada de 1 uma (unidad de masa atómica), mientras que un electrón es unas 1836 veces más ligero. Esto significa que, aunque los electrones son fundamentales para la química, su contribución a la masa total del átomo es mínima.
## La Importancia de Cada Partícula
Ahora que hemos cubierto las diferencias básicas, es esencial entender por qué cada una de estas partículas es tan importante.
### Protones y la Identidad del Elemento
Los protones son la clave para la identidad de un elemento. Cambiar el número de protones en un átomo significa que estás tratando con un elemento completamente diferente. Por ejemplo, si tomas un átomo de carbono, que tiene seis protones, y le agregas un protón, obtienes nitrógeno. ¡Así de poderoso es el protón!
### Neutrones y Estabilidad Nuclear
Los neutrones, aunque no tienen carga, son vitales para la estabilidad del núcleo. Un núcleo con demasiados o muy pocos neutrones en comparación con los protones puede volverse inestable y, como resultado, puede desintegrarse. Este fenómeno es lo que da lugar a la radiactividad. ¿Te imaginas un castillo donde los muros son demasiado delgados? ¡No duraría mucho!
### Electrones y Reacciones Químicas
Los electrones son los verdaderos héroes cuando se trata de reacciones químicas. La forma en que los electrones se distribuyen en un átomo determina cómo interactuará con otros átomos. Por ejemplo, los átomos pueden compartir electrones (unión covalente) o transferir electrones (unión iónica) para formar compuestos. ¡Sin electrones, no habría química!
## La Relación entre Protones, Neutrones y Electrones
Ahora que tenemos una idea clara de cada partícula, hablemos de cómo se relacionan entre sí. Este trío es como un equipo de fútbol, donde cada jugador tiene un papel esencial. Sin uno de ellos, el equipo no puede funcionar correctamente.
### Formación de Átomos
La combinación de protones y neutrones en el núcleo forma el corazón del átomo, mientras que los electrones orbitan alrededor de este núcleo, formando «nubes» de electrones. Esta estructura es lo que le da al átomo su forma y propiedades únicas. Cuando los átomos se unen para formar moléculas, es la disposición de los electrones la que determina cómo se comportan estas moléculas.
### Interacciones y Fuerzas
Las interacciones entre estas partículas están regidas por fuerzas fundamentales de la naturaleza, como la fuerza electromagnética y la fuerza nuclear fuerte. La fuerza electromagnética es la que mantiene unidos a los electrones y protones, mientras que la fuerza nuclear fuerte es la que mantiene unidos a los protones y neutrones en el núcleo. Sin estas fuerzas, los átomos no existirían, y por ende, ¡nosotros tampoco!
## Preguntas Frecuentes
### 1. ¿Pueden los protones convertirse en neutrones?
Sí, en ciertas condiciones, como durante la desintegración beta, un protón puede convertirse en un neutrón. Este proceso implica la emisión de un positrón y un neutrino.
### 2. ¿Qué pasaría si un átomo tuviera más electrones que protones?
Si un átomo tiene más electrones que protones, se convierte en un ion negativo, conocido como anión. Esto puede influir en su reactividad química.
### 3. ¿Son los neutrones realmente necesarios?
¡Absolutamente! Sin neutrones, los núcleos atómicos serían inestables debido a la repulsión entre los protones. Esto significa que los neutrones son esenciales para la estabilidad del átomo.
### 4. ¿Cómo afectan los electrones a la química diaria?
Los electrones son responsables de la formación de enlaces químicos, lo que permite que los átomos se unan para formar moléculas. Esto afecta todo, desde la comida que comemos hasta los productos que utilizamos.
### 5. ¿Qué papel juegan los protones en la energía nuclear?
En la energía nuclear, los protones y neutrones dentro del núcleo pueden ser manipulados para liberar grandes cantidades de energía a través de procesos como la fisión y la fusión nuclear.
En resumen, los electrones, protones y neutrones son los ladrillos fundamentales de la materia. Sin ellos, no habría universo, y nuestra comprensión de la ciencia sería completamente diferente. Así que la próxima vez que mires a tu alrededor, recuerda que todo está hecho de estas diminutas pero poderosas partículas. ¡El mundo subatómico es realmente fascinante!