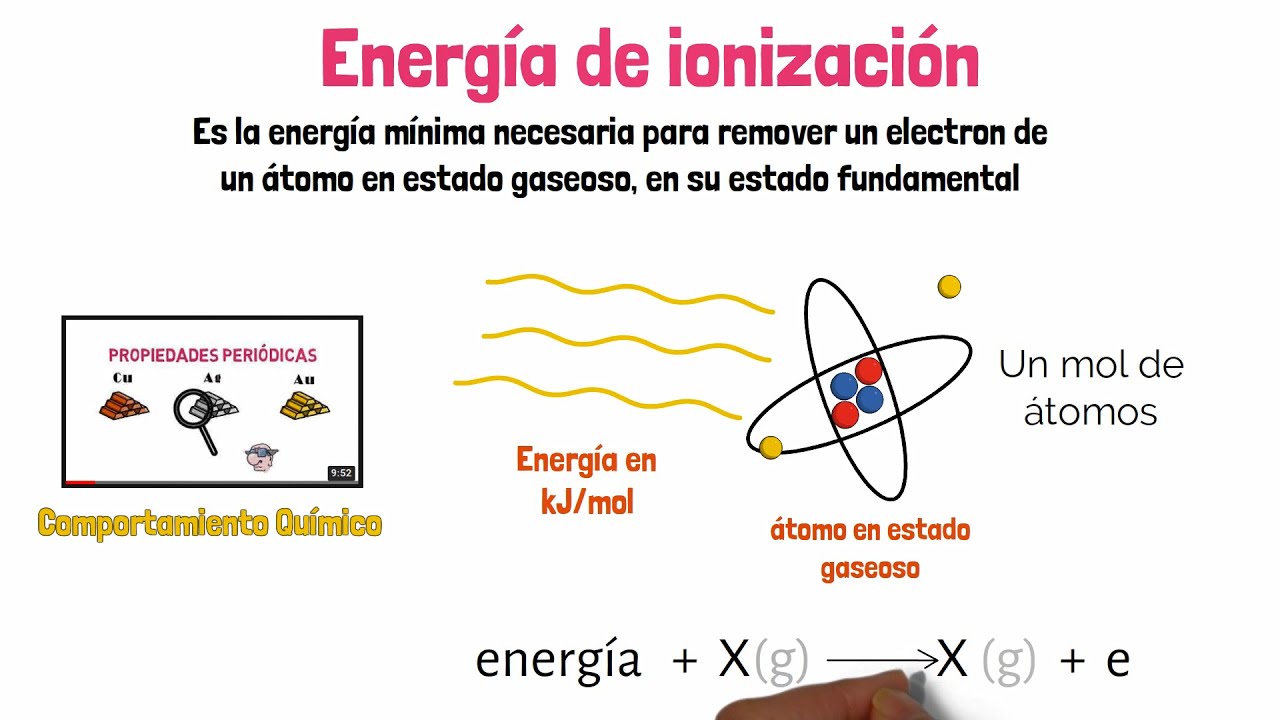
La energía de ionización es un concepto fundamental en la química y la física que a menudo se pasa por alto en el día a día, pero que tiene un impacto significativo en cómo interactúan los átomos y las moléculas entre sí. ¿Alguna vez te has preguntado cómo se forman los iones o qué hace que un átomo sea más propenso a perder un electrón? ¡Aquí es donde entra en juego la energía de ionización! En términos simples, se refiere a la cantidad de energía que se necesita para quitar un electrón de un átomo o ion en su estado gaseoso. Pero, ¿por qué es tan importante? La respuesta radica en cómo esta energía afecta las propiedades químicas de los elementos y su comportamiento en diferentes reacciones.
Imagina que los electrones son como pequeños globos que están atados a una casa (el núcleo del átomo). La energía de ionización sería como la fuerza que necesitas para desatar esos globos y dejarlos volar. Cuanto más fuerte sea la atadura, más difícil será desatar el globo. En este caso, la atadura es la atracción entre el electrón y el núcleo. Entonces, ¿qué factores influyen en esta energía? La respuesta es más compleja de lo que parece y varía entre diferentes elementos, pero vamos a desglosarlo paso a paso.
¿Qué Influye en la Energía de Ionización?
La energía de ionización no es un número fijo; varía de un elemento a otro. Pero, ¿qué la determina? Hay varios factores clave a considerar.
Carga Nuclear Efectiva
La carga nuclear efectiva es una de las principales influencias en la energía de ionización. Cuanto mayor sea la carga positiva del núcleo, más fuerte será la atracción hacia los electrones. Por ejemplo, los elementos del grupo 1, como el litio y el sodio, tienen una carga nuclear efectiva relativamente baja, lo que significa que sus electrones de valencia son más fáciles de quitar. En contraste, los elementos del grupo 17, como el flúor, tienen una carga nuclear efectiva más alta, lo que los hace más difíciles de ionizar.
Niveles de Energía Electrónica
Los electrones en un átomo se organizan en niveles de energía. Cuanto más lejos esté un electrón del núcleo, menos energía se necesita para sacarlo. Imagina que estás tratando de sacar un juguete de una caja. Si el juguete está en el fondo de la caja (cerca del núcleo), será más difícil de alcanzar que si está en la parte superior (lejos del núcleo). Así, los electrones en niveles de energía más altos son más susceptibles a ser ionizados.
Efecto de Apantallamiento
El efecto de apantallamiento se refiere a cómo los electrones internos pueden reducir la atracción entre el núcleo y los electrones externos. Es como si tuvieras varios globos en una habitación; si hay otros globos que te bloquean la vista del globo que quieres alcanzar, será más difícil llegar a él. Esto significa que los electrones más cercanos al núcleo pueden disminuir la energía necesaria para quitar un electrón de un nivel más externo.
¿Cómo se Calcula la Energía de Ionización?
Calcular la energía de ionización no es tan sencillo como hacer una suma, pero podemos desglosar el proceso en pasos más manejables.
Métodos Experimentales
La energía de ionización se mide experimentalmente utilizando técnicas como la espectroscopía de fotoelectrones. En este método, se irradia un átomo con luz de alta energía, y se mide la energía de los electrones que se expulsan. Este proceso permite a los científicos determinar cuánta energía se necesita para ionizar un átomo específico.
Ecuaciones Teóricas
Aparte de los métodos experimentales, también hay enfoques teóricos para calcular la energía de ionización. Las ecuaciones cuánticas y los modelos atómicos, como el modelo de Bohr, ofrecen estimaciones basadas en la estructura electrónica del átomo. Aunque estos métodos pueden ser más complejos, ofrecen una visión valiosa sobre cómo se comportan los electrones en un átomo.
La Importancia de la Energía de Ionización
Ahora que hemos establecido qué es la energía de ionización y cómo se calcula, hablemos de por qué deberías preocuparte por esto. La energía de ionización juega un papel crucial en la química y la biología, afectando la reactividad de los elementos, la formación de enlaces y mucho más.
Reacciones Químicas
La energía de ionización influye en cómo y por qué ocurren las reacciones químicas. Por ejemplo, los metales alcalinos (como el sodio) tienen baja energía de ionización, lo que significa que son altamente reactivos y tienden a perder electrones fácilmente. Esto es lo que los hace tan propensos a reaccionar con otros elementos, como el cloro, para formar compuestos.
Propiedades Físicas y Químicas
La energía de ionización también afecta las propiedades físicas y químicas de los elementos. Por ejemplo, los gases nobles tienen una energía de ionización muy alta, lo que los hace inertes y poco reactivos. En cambio, los metales de transición, que tienen energías de ionización más bajas, son conocidos por su capacidad para formar compuestos complejos.
Aplicaciones Prácticas
En el mundo real, entender la energía de ionización tiene aplicaciones prácticas en campos como la medicina, la ingeniería y la tecnología. Por ejemplo, en la fabricación de semiconductores, es fundamental conocer la energía de ionización de los materiales utilizados para optimizar su rendimiento.
¿La energía de ionización es la misma para todos los elementos?
No, la energía de ionización varía de un elemento a otro y depende de varios factores, como la carga nuclear efectiva y los niveles de energía electrónica.
¿Por qué los gases nobles son tan estables?
Los gases nobles tienen altas energías de ionización, lo que significa que es difícil quitarles electrones. Esto los hace inertes y menos propensos a reaccionar con otros elementos.
¿Cómo afecta la energía de ionización la formación de compuestos?
La energía de ionización determina la reactividad de un elemento. Elementos con baja energía de ionización tienden a perder electrones fácilmente, formando cationes, mientras que aquellos con alta energía de ionización son más propensos a ganar electrones, formando aniones.
¿Qué sucede si un átomo pierde varios electrones?
Cuando un átomo pierde más de un electrón, se generan iones con carga positiva. La energía de ionización necesaria para quitar electrones adicionales suele ser mayor que la primera, debido a la creciente carga positiva del ion.
¿Cómo se relaciona la energía de ionización con la electronegatividad?
Aunque son conceptos diferentes, hay una relación entre la energía de ionización y la electronegatividad. En general, los elementos con alta energía de ionización también tienden a tener alta electronegatividad, ya que ambos conceptos están relacionados con la atracción de electrones.
Con todo esto en mente, ahora tienes una visión más clara sobre la energía de ionización, su importancia y cómo afecta el mundo que nos rodea. ¿Te has dado cuenta de que hay mucho más en juego de lo que parece a simple vista? La química está llena de sorpresas y conexiones fascinantes, y la energía de ionización es solo una de las muchas piezas del rompecabezas.