¿Qué es la Energía de Ionización y por qué es importante?
La energía necesaria para arrancar un electrón de un átomo es un concepto fascinante y esencial en el mundo de la química y la física. Pero, ¿qué significa realmente esto? En términos sencillos, la energía de ionización es la cantidad de energía que se necesita para quitar un electrón de un átomo en estado gaseoso. Imagina que el átomo es una especie de «planeta» y el electrón es su «satélite». Para liberar al satélite de la atracción gravitacional del planeta, necesitas aplicar una fuerza, en este caso, energía. Cuanto más fuerte sea la atracción, más energía necesitarás. Este principio es fundamental para entender muchas reacciones químicas y el comportamiento de los elementos en la tabla periódica.
Ahora, hablemos de por qué deberías preocuparte por esto. ¿Alguna vez has oído hablar de cómo los electrones son responsables de la electricidad? O quizás te has preguntado por qué algunos elementos son más reactivos que otros. La respuesta a estas preguntas se encuentra en la energía de ionización. Cada elemento tiene su propia «huella dactilar» de energía de ionización, que influye en cómo interactúa con otros elementos y compuestos. A medida que profundizamos en este tema, exploraremos cómo varía la energía de ionización entre diferentes grupos de elementos y cómo esto afecta nuestras vidas diarias.
La Energía de Ionización: Un Concepto Fundamental
La energía de ionización no es solo un término técnico; es la clave para entender la química detrás de los elementos. Hay que saber que no todos los electrones son iguales. Los electrones más cercanos al núcleo de un átomo están más fuertemente ligados debido a la fuerza de atracción entre el núcleo cargado positivamente y los electrones cargados negativamente. Por lo tanto, los electrones en las capas externas son más fáciles de quitar. Esto significa que, en general, los elementos en el lado izquierdo de la tabla periódica (como los metales alcalinos) tienen energías de ionización más bajas que los elementos en el lado derecho (como los gases nobles).
Entonces, ¿qué factores influyen en la energía de ionización? Hay varios. Uno de los más importantes es el tamaño del átomo. A medida que los átomos se vuelven más grandes, la distancia entre el núcleo y el electrón externo aumenta, lo que significa que la fuerza de atracción disminuye. Por lo tanto, se necesita menos energía para arrancar ese electrón. Además, la carga nuclear efectiva también juega un papel crucial. Un núcleo más cargado puede atraer electrones más fuertemente, lo que resulta en una mayor energía de ionización.
Tipos de Energía de Ionización
Existen diferentes tipos de energía de ionización, y es importante diferenciarlos. La primera energía de ionización es la energía necesaria para quitar el primer electrón. Pero, ¿qué pasa después? Cuando un electrón es removido, el átomo se convierte en un ion positivo. Para quitar un segundo electrón, se requiere la segunda energía de ionización, que suele ser mayor que la primera. Esto se debe a que el ion positivo resultante tiene una carga más alta, lo que significa que el siguiente electrón está más fuertemente atraído al núcleo.
Imagina que intentas quitar una bola de un grupo de imanes. La primera bola es relativamente fácil de sacar, pero una vez que quitas la primera, las otras bolas se sienten más atraídas por los imanes, y necesitas aplicar más fuerza. Este es el mismo principio que se aplica a la energía de ionización.
Variaciones en la Energía de Ionización a lo Largo de la Tabla Periódica
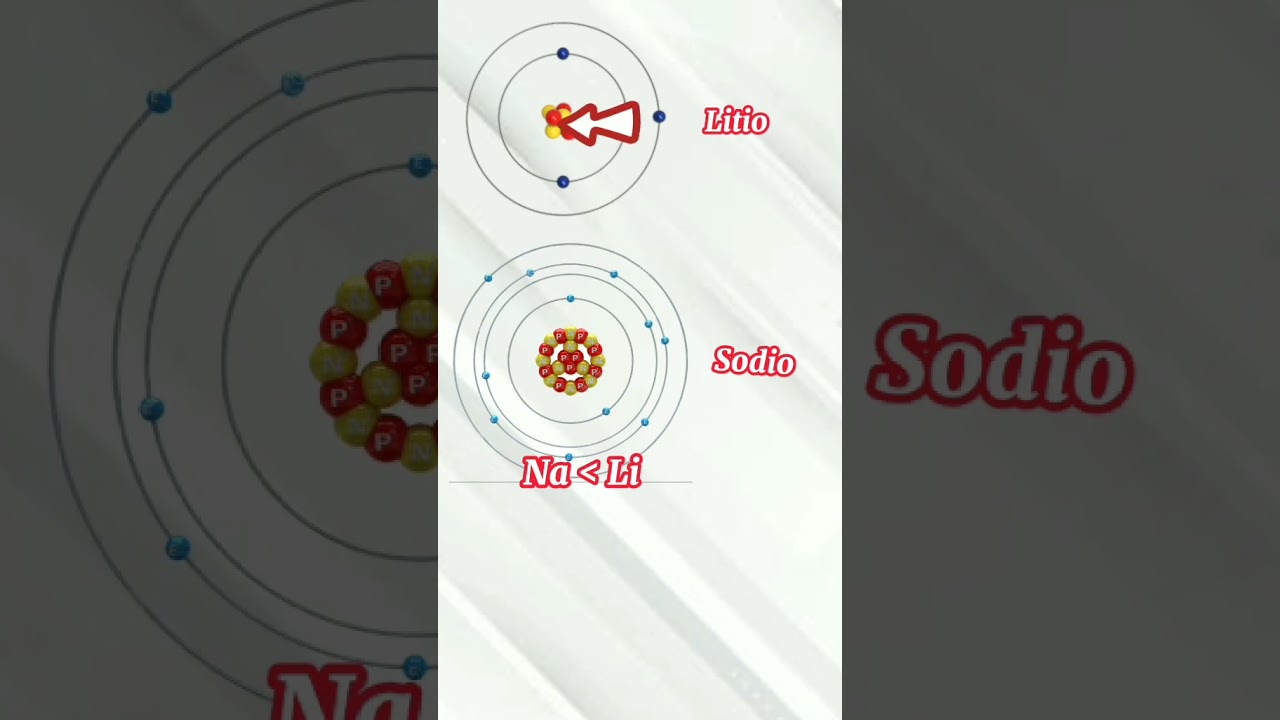
Al observar la tabla periódica, notarás algunas tendencias interesantes. A medida que te mueves de izquierda a derecha, la energía de ionización generalmente aumenta. Esto se debe a que los átomos se vuelven más pequeños y la carga nuclear efectiva aumenta. Por otro lado, si te desplazas hacia abajo en un grupo, la energía de ionización tiende a disminuir. Esto es porque los átomos son más grandes y los electrones externos están más alejados del núcleo.
Por ejemplo, el litio, que se encuentra en el grupo de los metales alcalinos, tiene una energía de ionización bastante baja. En cambio, el flúor, que está en el grupo de los halógenos, tiene una energía de ionización mucho más alta. Esto es lo que hace que el flúor sea tan reactivo; realmente quiere atraer electrones para completar su capa de valencia.
La Energía de Ionización y la Reactividad Química
La relación entre la energía de ionización y la reactividad química es un tema apasionante. Los elementos que tienen una baja energía de ionización, como los metales alcalinos, son extremadamente reactivos. Esto se debe a que les resulta fácil perder un electrón y formar iones positivos. En cambio, los elementos con alta energía de ionización, como los gases nobles, son muy estables y tienden a no reaccionar con otros elementos.
¿Alguna vez te has preguntado por qué el sodio reacciona violentamente con el agua mientras que el helio no hace nada? La respuesta está en la energía de ionización. El sodio tiene una energía de ionización baja, lo que le permite perder su electrón fácilmente y reaccionar con el agua. Por otro lado, el helio tiene una energía de ionización muy alta, lo que lo convierte en un «chico tranquilo» en el mundo de los elementos.
Aplicaciones Prácticas de la Energía de Ionización
Ahora que hemos establecido qué es la energía de ionización y por qué es importante, ¿cómo se aplica esto en el mundo real? Hay varias aplicaciones prácticas que se derivan de este concepto. Por ejemplo, en la industria de la electrónica, la energía de ionización es crucial para el diseño de semiconductores. Los materiales semiconductores tienen propiedades únicas que dependen de la capacidad de los electrones para ser removidos o añadidos. La energía de ionización ayuda a determinar cómo se comportarán estos materiales en diferentes condiciones.
Además, la energía de ionización también tiene un papel en la espectroscopía. Esta técnica se utiliza para identificar la composición de diferentes sustancias al analizar cómo absorben o emiten luz. Al conocer las energías de ionización de los elementos, los científicos pueden deducir la presencia de ciertos elementos en una muestra, lo que es invaluable en campos como la astronomía y la química forense.
La Energía de Ionización en la Investigación Científica
La energía de ionización no solo es importante en aplicaciones industriales, sino que también es un tema de investigación activa. Los científicos están constantemente buscando entender mejor cómo la energía de ionización afecta la formación de enlaces químicos y la estabilidad de las moléculas. Este conocimiento podría tener implicaciones en el desarrollo de nuevos materiales, fármacos y tecnologías energéticas.
Por ejemplo, en el campo de la energía solar, la investigación sobre la energía de ionización puede ayudar a diseñar mejores celdas solares que capturen la luz de manera más eficiente. Al comprender cómo los electrones se comportan en diferentes materiales, los científicos pueden crear dispositivos que aprovechen la energía solar de manera más efectiva.
- ¿Qué es la energía de ionización? Es la cantidad de energía necesaria para remover un electrón de un átomo en estado gaseoso.
- ¿Por qué varía la energía de ionización entre diferentes elementos? Varía debido a factores como el tamaño del átomo y la carga nuclear efectiva.
- ¿Qué relación hay entre la energía de ionización y la reactividad química? Los elementos con baja energía de ionización son más reactivos, mientras que los de alta energía de ionización son más estables.
- ¿Cómo se aplica la energía de ionización en la industria? Se utiliza en el diseño de semiconductores y en técnicas de espectroscopía.
- ¿Es la energía de ionización un tema de investigación actual? Sí, es un área activa de investigación con aplicaciones potenciales en nuevos materiales y tecnologías.
En conclusión, la energía de ionización es un concepto fundamental que influye en la química, la física y muchas aplicaciones prácticas en nuestras vidas. Desde entender la reactividad de los elementos hasta su aplicación en la tecnología moderna, este tema es más relevante de lo que podrías imaginar. ¡Así que la próxima vez que escuches sobre electrones y energía, recuerda que hay todo un universo de ciencia detrás de esos conceptos!