¿Alguna vez te has preguntado cómo está hecho todo lo que te rodea? Desde el aire que respiras hasta el café que tomas por la mañana, todo está compuesto por átomos. Pero, ¿qué es un átomo exactamente? En este artículo, vamos a explorar los diferentes modelos atómicos que han sido propuestos a lo largo de la historia y cómo cada uno de ellos ha contribuido a nuestra comprensión actual de la materia. Así que, siéntate, relájate y acompáñame en este fascinante viaje a través del mundo microscópico de los átomos.
La historia de los modelos atómicos es como una novela de misterio llena de giros y sorpresas. Desde la antigua Grecia, donde filósofos como Demócrito imaginaron que todo estaba hecho de partículas indivisibles, hasta los complejos modelos cuánticos de hoy, cada teoría ha aportado algo valioso. Así que, ¿por dónde empezamos? Vamos a desglosar cada modelo atómico, sus características y la importancia que tuvo en su época.
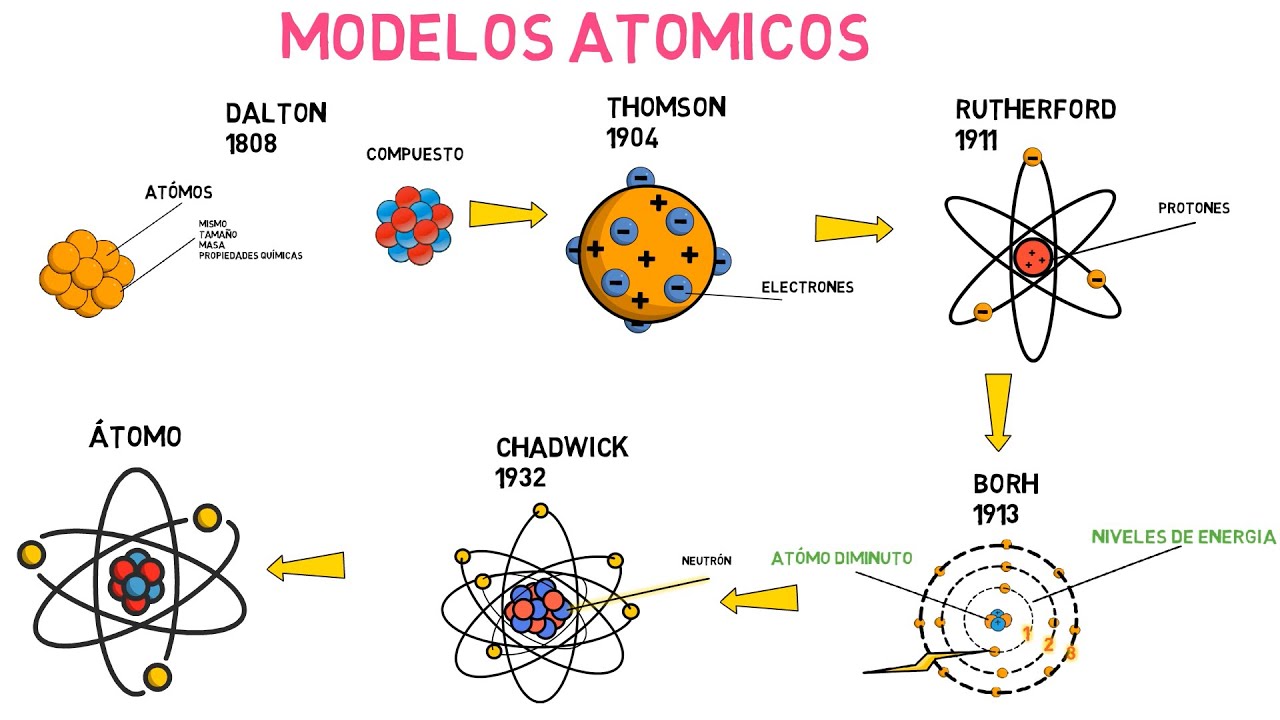
Modelo de Dalton: El Átomo como Esfera Sólida
Comencemos con el primer modelo atómico formal, el propuesto por John Dalton a principios del siglo XIX. Dalton imaginó que los átomos eran esferas sólidas e indivisibles, un poco como canicas en un saco. Según su teoría, cada elemento estaba compuesto por átomos de un tipo particular, y los compuestos se formaban cuando los átomos de diferentes elementos se unían en proporciones fijas.
Este modelo fue un gran avance porque introdujo la idea de que los átomos son la unidad básica de la materia. Sin embargo, había un pequeño problema: no todos los átomos son esferas perfectas. ¡Sorpresa! A medida que avanzamos en el tiempo, empezamos a descubrir que los átomos son mucho más complejos de lo que Dalton imaginó.
Características del Modelo de Dalton
– Indivisibilidad: Dalton creía que los átomos eran partículas indivisibles.
– Uniformidad: Todos los átomos de un mismo elemento son idénticos.
– Proporciones fijas: Los compuestos se forman en proporciones definidas y constantes.
Modelo de Thomson: El Pudín de Pasas
Después de Dalton, llegó J.J. Thomson a finales del siglo XIX. Su experimento con tubos de rayos catódicos le llevó a descubrir el electrón, una partícula subatómica. Imagínate un pudín de pasas: el pudín representa la esfera positiva del átomo y las pasas son los electrones negativos incrustados en él. Así es como Thomson visualizó su modelo atómico.
El modelo de Thomson fue revolucionario porque introdujo la idea de que los átomos no son indivisibles, sino que están compuestos por partículas más pequeñas. Sin embargo, este modelo no podía explicar la estabilidad de los átomos ni su estructura. ¡Vaya lío!
Características del Modelo de Thomson
– Electrones: Introducción de los electrones como partículas negativas.
– Carga positiva: Una esfera de carga positiva que equilibra la carga negativa de los electrones.
– Estructura difusa: La carga positiva está distribuida uniformemente, como un pudín.
Modelo de Rutherford: El Núcleo Denso
A principios del siglo XX, Ernest Rutherford llevó a cabo un experimento famoso con partículas alfa y una lámina de oro delgada. Lo que descubrió fue sorprendente: la mayoría de las partículas pasaron a través de la lámina, pero algunas se desviaron. ¿Qué significaba esto? Rutherford concluyó que el átomo tenía un núcleo pequeño y denso, donde se concentraba la mayor parte de su masa, y que estaba rodeado por una nube de electrones.
Este modelo fue un gran avance porque proporcionó una imagen más precisa de la estructura atómica, pero aún había preguntas sin respuesta. Por ejemplo, ¿cómo se mantenían los electrones en órbita alrededor del núcleo sin caer en él? Este dilema fue el siguiente en la lista de tareas de los científicos.
Características del Modelo de Rutherford
– Núcleo denso: Un núcleo central que contiene protones y neutrones.
– Electrones en órbita: Los electrones giran alrededor del núcleo, como planetas alrededor del sol.
– Mayor espacio vacío: La mayor parte del átomo es espacio vacío.
Modelo de Bohr: Órbitas Estacionarias
Niels Bohr, en 1913, tomó el modelo de Rutherford y lo mejoró al proponer que los electrones orbitan el núcleo en niveles de energía específicos. Imagina que los electrones son como coches en una autopista, cada uno en su carril, sin poder cambiar de carril a menos que ganen suficiente energía. Este modelo ayudó a explicar la estabilidad de los átomos y por qué emiten o absorben luz en longitudes de onda específicas.
Sin embargo, aunque el modelo de Bohr fue un gran avance, aún no podía explicar todos los fenómenos observados en átomos más complejos.
Características del Modelo de Bohr
– Niveles de energía: Los electrones ocupan órbitas específicas o niveles de energía.
– Cuantización: Los electrones pueden moverse entre niveles de energía al absorber o emitir energía.
– Estabilidad: Este modelo explica la estabilidad de los átomos.
Modelo Cuántico: La Dualidad de Partícula y Onda
Finalmente, llegamos al modelo cuántico, que es el que usamos hoy en día. A medida que avanzaba la ciencia, se descubrió que los electrones no se comportan solo como partículas, sino también como ondas. Esto significa que no se pueden localizar en un punto específico, sino que tienen una probabilidad de estar en diferentes lugares. Imagina que en lugar de ver un coche en la carretera, ves una nube que representa la probabilidad de dónde podría estar ese coche en cualquier momento.
El modelo cuántico es mucho más complejo y utiliza ecuaciones matemáticas avanzadas para describir el comportamiento de los electrones. Aunque puede parecer complicado, ha permitido a los científicos hacer predicciones precisas sobre la química y la física.
Características del Modelo Cuántico
– Dualidad onda-partícula: Los electrones exhiben propiedades tanto de partículas como de ondas.
– Nubes de probabilidad: En lugar de órbitas fijas, los electrones existen en nubes de probabilidad.
– Principio de incertidumbre: No se puede conocer simultáneamente la posición y la velocidad exactas de un electrón.
Comparación de Modelos Atómicos
Ahora que hemos recorrido la historia de los modelos atómicos, es interesante compararlos. Cada modelo fue un paso hacia adelante, corrigiendo los errores y ampliando nuestro conocimiento. Aquí hay un resumen rápido:
| Modelo | Indivisibilidad | Núcleo | Electrones | Niveles de Energía |
|—————–|—————–|—————|————|———————|
| Dalton | Sí | No | No | No |
| Thomson | No | No | Sí | No |
| Rutherford | No | Sí | Sí | No |
| Bohr | No | Sí | Sí | Sí |
| Cuántico | No | Sí | Sí | Sí |
Aplicaciones de los Modelos Atómicos
Los modelos atómicos no son solo teoría; tienen aplicaciones prácticas en el mundo real. Desde la creación de nuevos materiales hasta la medicina, entender la estructura atómica es fundamental. Por ejemplo, la teoría cuántica es la base de la química cuántica, que ayuda a desarrollar nuevos fármacos y tratamientos.
Además, la tecnología moderna, como los semiconductores y la computación cuántica, se basa en principios atómicos. Así que, la próxima vez que uses tu teléfono o navegues por Internet, recuerda que detrás de todo eso hay un mundo de átomos trabajando en perfecta armonía.
En resumen, los modelos atómicos han evolucionado significativamente a lo largo del tiempo. Desde la idea inicial de Dalton de un átomo indivisible hasta el complejo modelo cuántico que tenemos hoy, cada teoría ha añadido una pieza al rompecabezas. A medida que la ciencia avanza, es probable que sigamos aprendiendo más sobre la naturaleza de la materia.
Recuerda que la curiosidad es una de las mejores herramientas que tenemos. Así que, ¿por qué no te animas a investigar un poco más sobre este tema fascinante?
1. ¿Por qué es importante estudiar los modelos atómicos?
Los modelos atómicos nos ayudan a entender la composición de la materia y cómo interactúan los elementos, lo cual es fundamental para el desarrollo de la química y la física.
2. ¿Cuál es el modelo atómico más aceptado hoy en día?
El modelo cuántico es el más aceptado y utilizado, ya que explica de manera precisa el comportamiento de los electrones y su interacción con el núcleo.
3. ¿Los átomos son realmente indivisibles?
No, los átomos están compuestos por partículas subatómicas (protones, neutrones y electrones), lo que significa que no son indivisibles.
4. ¿Cómo afecta el modelo cuántico a la tecnología moderna?
El modelo cuántico es la base de muchas tecnologías modernas, incluidos los semiconductores, láseres y computación cuántica.
5. ¿Se pueden crear nuevos elementos a partir de átomos existentes?
Sí, mediante procesos como la fusión nuclear, se pueden combinar átomos para crear nuevos elementos, aunque esto generalmente requiere condiciones extremas.
¿Listo para explorar más sobre el mundo de los átomos? ¡Sigue investigando!