Un Viaje a Través del Tiempo: Cómo Entendimos la Materia
La historia del modelo atómico es como un emocionante viaje en una máquina del tiempo, donde cada parada nos ofrece un vistazo a cómo hemos llegado a entender la materia que compone todo lo que nos rodea. Desde las primeras ideas de los filósofos griegos hasta las complejas teorías del siglo XXI, cada avance ha sido un paso crucial en la construcción de nuestro conocimiento. ¿Alguna vez te has preguntado cómo un simple concepto como el «átomo» ha evolucionado tanto? En este artículo, exploraremos ese fascinante camino, desglosando cada modelo y sus contribuciones a la ciencia.
Los Primeros Pasos: Dalton y la Teoría Atómica
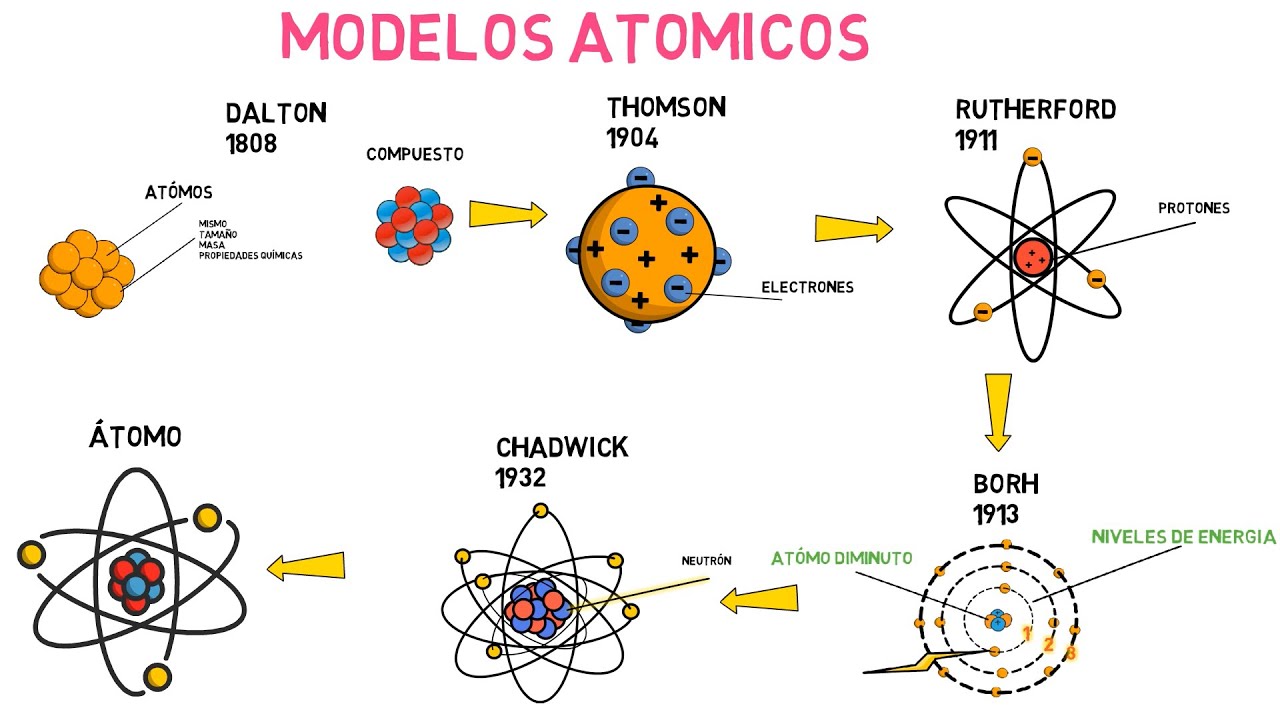
Comencemos nuestro viaje en el siglo XIX, cuando un hombre llamado John Dalton decidió que era hora de poner un poco de orden en el caos que era la química de su época. Antes de Dalton, la idea de que todo estaba compuesto por pequeñas partículas era más una conjetura que una realidad científica. En 1803, Dalton propuso su famosa teoría atómica, donde afirmaba que la materia está compuesta por átomos indivisibles, cada uno con su propia masa y propiedades. Imagina que cada átomo es como una pequeña esfera de boliche, cada una con su propio color y peso. Esta idea fue revolucionaria, ya que sentó las bases para la química moderna.
La Ley de las Proporciones Múltiples
Una de las contribuciones más destacadas de Dalton fue la Ley de las Proporciones Múltiples, que decía que cuando dos elementos se combinan para formar diferentes compuestos, las masas de uno de los elementos que se combinan con una cantidad fija del otro son siempre una relación de números enteros simples. ¿Suena complicado? Imagina que tienes bloques de construcción de diferentes colores: si solo puedes usar un bloque rojo para cada bloque azul, pero puedes usar uno, dos o tres bloques amarillos para cada bloque azul, eso es lo que Dalton estaba diciendo. Esta idea ayudó a los químicos a entender cómo se forman los compuestos.
Avances en la Comprensión: Thomson y el Modelo del Pudín de Ciruelas
Pasemos a finales del siglo XIX y conozcamos a J.J. Thomson, quien en 1897 hizo un descubrimiento que cambiaría todo. Al estudiar los rayos catódicos, descubrió que los átomos no eran esferas indivisibles, sino que contenían partículas más pequeñas llamadas electrones. ¡Bingo! Thomson propuso el modelo del «pudín de ciruelas», donde los electrones estaban incrustados en una esfera positiva, como las ciruelas en un pudín. Aunque este modelo era incorrecto en su totalidad, fue un gran avance en la comprensión de la estructura atómica. ¿Alguna vez has visto un pudín? Ahora imagina que cada ciruela es un electrón que flota en una mezcla espesa. Esa era la visión de Thomson.
El Experimento de Rutherford: Descubriendo el Núcleo
La historia no se detiene aquí. En 1911, Ernest Rutherford llevó a cabo su famoso experimento de dispersión de partículas alfa. Al bombardear una delgada lámina de oro con estas partículas, se dio cuenta de que algunas rebotaban en ángulos inesperados. ¿Qué significaba esto? Que había algo denso y positivo en el átomo: el núcleo. Rutherford propuso un nuevo modelo atómico donde los electrones giraban alrededor de un núcleo central, similar a cómo los planetas orbitan alrededor del sol. ¡Qué idea tan brillante! Ahora, los átomos se parecían más a un sistema solar en miniatura.
La Cuántica Toma el Escenario: Bohr y el Modelo Planetario
Avancemos a 1913, cuando Niels Bohr entró en escena. Bohr tomó el modelo de Rutherford y lo combinó con la teoría cuántica emergente. Propuso que los electrones orbitan el núcleo en niveles de energía específicos, como los peldaños de una escalera. Esto significaba que los electrones no podían estar en cualquier lugar, solo en esos niveles de energía definidos. Imagina que estás subiendo una escalera: no puedes estar en el medio de dos escalones, solo en uno o en otro. Esta idea fue un gran avance en la comprensión de la estructura atómica y ayudó a explicar la emisión de luz por los átomos.
Las Líneas Espectrales: Un Enigma Resuelto
Bohr también logró explicar las líneas espectrales de los elementos, algo que había desconcertado a los científicos. Cuando los átomos son excitados, emiten luz en longitudes de onda específicas, lo que se traduce en colores específicos. Bohr demostró que esto se debía a que los electrones se movían entre diferentes niveles de energía. Así, la luz que vemos de un elemento es como una huella digital única. ¿No es asombroso pensar que la luz puede contarnos tanto sobre la estructura interna de un átomo?
El Modelo Cuántico: De Schrödinger a Heisenberg
Ahora, vamos a la década de 1920, donde la mecánica cuántica comenzó a tomar forma. Aquí es donde el escenario se vuelve un poco más complejo, pero emocionante. Erwin Schrödinger introdujo su famosa ecuación de onda, que describe cómo se comportan los electrones como ondas. A diferencia del modelo de Bohr, que visualizaba electrones como partículas en órbitas fijas, Schrödinger propuso que los electrones existen en nubes de probabilidad. Imagina que en lugar de tener un camino definido, los electrones son como una multitud en una fiesta, moviéndose y dispersándose en un área. Esto significa que, en lugar de saber exactamente dónde está un electrón, solo podemos calcular la probabilidad de encontrarlo en un lugar determinado.
El Principio de Incertidumbre de Heisenberg
Por otro lado, Werner Heisenberg, con su principio de incertidumbre, añadió otra capa de complejidad. Este principio establece que no podemos conocer simultáneamente la posición y la velocidad de un electrón con precisión. Cuanto más precisamente intentemos medir una de estas propiedades, menos precisión tendremos en la otra. Es como intentar seguir a un pez en un estanque: cuanto más rápido intentas atraparlo, más difícil es saber exactamente dónde está. Este principio revolucionó nuestra comprensión de la naturaleza de la materia y abrió la puerta a nuevas preguntas sobre la realidad misma.
El Modelo Atómico Moderno: Avances y Aplicaciones
Entramos en la segunda mitad del siglo XX y más allá, donde los avances en tecnología y experimentación nos han permitido explorar el mundo atómico con un detalle sin precedentes. La creación del acelerador de partículas y los microscopios electrónicos han permitido a los científicos observar los átomos y sus componentes de maneras que antes eran inimaginables. Hoy en día, el modelo atómico es un híbrido de todas las teorías anteriores, incorporando la mecánica cuántica y la relatividad para ofrecer una imagen más completa y precisa.
La Física de Partículas: Más Allá del Átomo
Con la llegada de la física de partículas, hemos descubierto que los átomos no son las partículas más pequeñas. En el corazón de cada átomo, los protones y neutrones están formados por quarks, partículas aún más pequeñas. Esto ha llevado a la creación del Modelo Estándar de la física de partículas, que describe las fuerzas fundamentales y las partículas que componen el universo. ¿No es fascinante pensar que, a pesar de que todo parece sólido y tangible, en el nivel más básico, todo está hecho de partículas diminutas que interactúan entre sí?
El Futuro del Modelo Atómico
Así que, ¿qué nos depara el futuro? Con los avances en la nanotecnología y la computación cuántica, el estudio del modelo atómico y sus aplicaciones están en constante evolución. Los científicos están trabajando en nuevas formas de manipular átomos y moléculas para desarrollar tecnologías revolucionarias, desde nuevos materiales hasta medicamentos más efectivos. La comprensión del átomo sigue siendo fundamental para la ciencia y la tecnología modernas, y seguramente nos sorprenderá en los próximos años.
A lo largo de este viaje, hemos visto cómo nuestra comprensión del átomo ha evolucionado de manera impresionante. Desde las primeras ideas de Dalton hasta los avances modernos en la física de partículas, cada teoría ha contribuido a un cuadro más amplio. La ciencia es un viaje continuo de descubrimiento, y cada respuesta genera nuevas preguntas. ¿Cuál será el próximo gran descubrimiento en la ciencia atómica? ¿Cómo cambiará nuestra comprensión del universo? Solo el tiempo lo dirá.
- ¿Quién fue el primero en proponer la teoría atómica? John Dalton fue el primero en proponer una teoría atómica coherente a principios del siglo XIX.
- ¿Qué descubrimiento hizo J.J. Thomson? Thomson descubrió el electrón y propuso el modelo del pudín de ciruelas.
- ¿Qué es el principio de incertidumbre de Heisenberg? Este principio establece que no se pueden conocer simultáneamente la posición y la velocidad de una partícula con precisión.
- ¿Qué son los quarks? Los quarks son partículas fundamentales que forman protones y neutrones dentro de los núcleos atómicos.
- ¿Cómo ha influido la mecánica cuántica en el modelo atómico? La mecánica cuántica ha proporcionado un marco para entender el comportamiento de los electrones y la estructura atómica a nivel subatómico.