Un Viaje a Través del Tiempo: Descubriendo los Fundamentos del Átomo
¿Alguna vez te has preguntado cómo llegamos a entender la estructura de la materia? La historia del modelo atómico es como un emocionante rompecabezas que se ha ido armando a lo largo de los siglos, con cada científico aportando una pieza clave. Desde la simple idea de John Dalton en el siglo XIX hasta las complejidades de la mecánica cuántica, cada avance ha sido un escalón en nuestra comprensión del universo. En este artículo, te invito a acompañarme en este fascinante viaje a través del tiempo, donde exploraremos cómo hemos llegado a desentrañar los secretos del átomo.
Los Inicios: Dalton y la Teoría Atómica
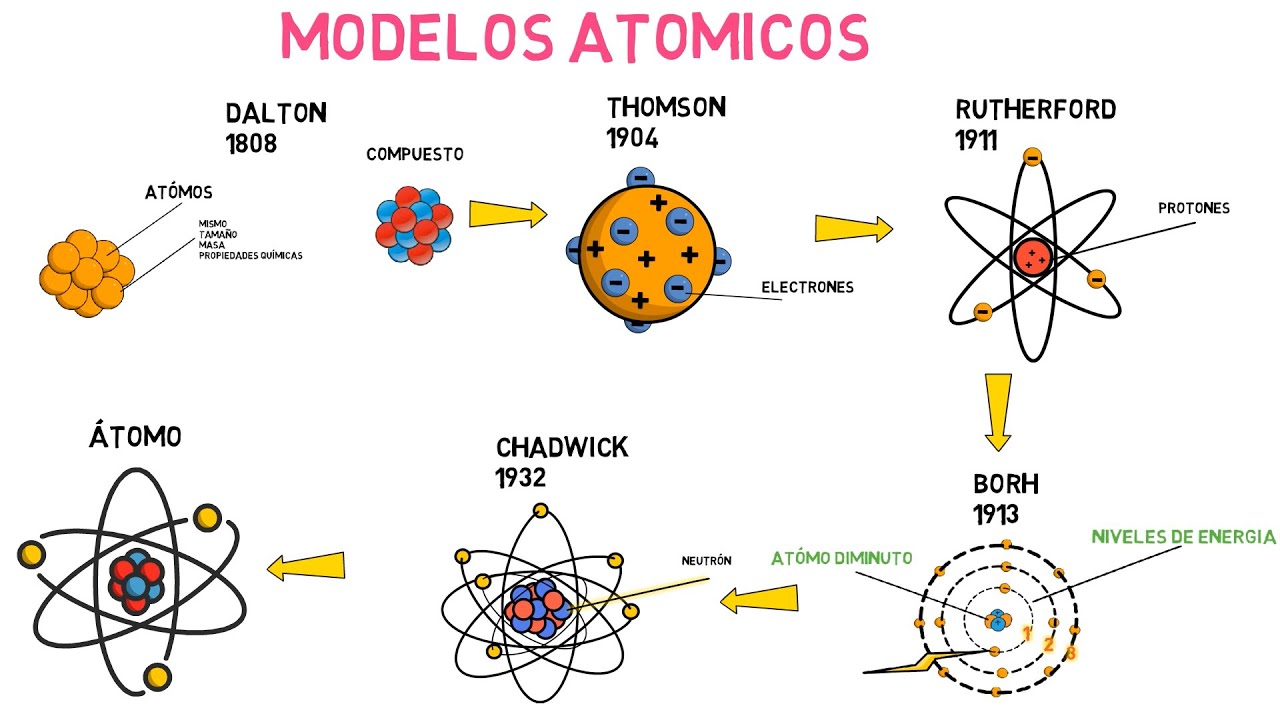
Todo comenzó en 1803, cuando John Dalton, un químico británico, propuso que la materia está compuesta por pequeñas partículas indivisibles llamadas átomos. Imagina que los átomos son como pequeñas pelotitas de billar que forman todo lo que nos rodea: desde el aire que respiramos hasta el agua que bebemos. Dalton no solo afirmó que los átomos eran indivisibles, sino que también sugirió que cada elemento tenía su propio tipo de átomo, cada uno con una masa específica. Esta idea fue revolucionaria para su tiempo, ya que sentó las bases de la química moderna. Sin embargo, como todo en la ciencia, esta teoría estaba destinada a evolucionar.
La Búsqueda de Nuevas Respuestas
Con el paso del tiempo, otros científicos comenzaron a cuestionar y expandir las ideas de Dalton. En 1897, J.J. Thomson hizo un descubrimiento que cambiaría el juego: ¡los electrones! Al realizar experimentos con tubos de rayos catódicos, Thomson demostró que los átomos no eran tan indivisibles como se pensaba. En lugar de eso, estaban compuestos por partículas más pequeñas. Imagina que ahora tienes una pelota de billar, pero al abrirla, descubres que hay pequeñas bolitas dentro. Thomson propuso un modelo conocido como el «modelo del pudín de ciruelas», donde los electrones estaban incrustados en una esfera de carga positiva. Aunque este modelo era un avance, todavía había mucho más por descubrir.
El Modelo de Rutherford: Una Nueva Perspectiva
En 1911, Ernest Rutherford llevó la investigación a un nuevo nivel. A través de su famoso experimento de dispersión de partículas alfa, demostró que el átomo tiene un núcleo central denso y positivo, rodeado por electrones que orbitan a su alrededor. ¡Imagina un pequeño sol en el centro de un sistema solar en miniatura! Este descubrimiento fue fundamental, ya que reveló que la mayor parte del átomo está compuesta de espacio vacío. Aunque el modelo de Rutherford fue un gran avance, también dejó muchas preguntas sin respuesta, especialmente sobre cómo los electrones podían orbitar sin caer en el núcleo.
La Revolución Cuántica: Bohr y Más Allá
La respuesta a esas preguntas llegó con Niels Bohr en 1913. Bohr propuso un modelo que combinaba la teoría cuántica con la estructura atómica. En lugar de pensar en los electrones como partículas que giran en órbitas al azar, sugirió que solo podían ocupar ciertos niveles de energía específicos. Es como si los electrones estuvieran en peldaños de una escalera: pueden subir o bajar, pero no pueden estar en medio de dos peldaños. Este modelo ayudó a explicar la estabilidad de los átomos y la emisión de luz en los espectros atómicos, aunque aún no resolvía todas las preguntas sobre la naturaleza de los electrones.
La Mecánica Cuántica: Un Mundo de Probabilidades
A medida que avanzamos en el tiempo, llegamos a la era de la mecánica cuántica, que comenzó a desarrollarse en la década de 1920. Aquí es donde las cosas se ponen realmente interesantes. En lugar de ver a los electrones como partículas en órbitas definidas, la mecánica cuántica los describe como nubes de probabilidad. Esto significa que no podemos saber con certeza dónde se encuentra un electrón en un momento dado, solo podemos calcular la probabilidad de encontrarlo en un lugar específico. Es como intentar localizar una mariposa en un jardín: en lugar de saber exactamente dónde está, solo puedes tener una idea de en qué área es más probable que la encuentres.
Principales Contribuciones a la Mecánica Cuántica
Entre los científicos que hicieron contribuciones significativas a la mecánica cuántica se encuentran Werner Heisenberg, con su principio de incertidumbre, y Erwin Schrödinger, quien formuló la ecuación que describe cómo evolucionan las funciones de onda de los electrones. La mecánica cuántica nos mostró que el mundo subatómico es mucho más extraño y fascinante de lo que habíamos imaginado. Las partículas pueden estar en múltiples estados al mismo tiempo, y fenómenos como el entrelazamiento cuántico desafían nuestra comprensión de la realidad. ¡Es como si el universo estuviera jugando a un juego de escondidas con nosotros!
El Modelo Estándar: Unificando las Fuerzas
En la segunda mitad del siglo XX, los físicos comenzaron a trabajar en un marco unificado conocido como el Modelo Estándar, que describe las partículas fundamentales y las fuerzas que actúan entre ellas. Este modelo combina las ideas de la mecánica cuántica con la relatividad de Einstein, ofreciendo una descripción más completa de cómo funciona el universo a nivel subatómico. Es fascinante pensar que todas las interacciones en el universo, desde la gravedad hasta las fuerzas electromagnéticas, pueden explicarse mediante este modelo. Sin embargo, aún quedan muchas preguntas sin respuesta, especialmente en lo que respecta a la materia oscura y la energía oscura.
Desafíos y Nuevas Fronteras
A medida que continuamos explorando el mundo de lo pequeño, nos encontramos con desafíos que nos llevan a cuestionar incluso las bases de la física moderna. La búsqueda de una teoría cuántica de la gravedad, que unifique la mecánica cuántica con la relatividad general, es uno de los mayores retos que enfrentamos hoy en día. Imagina intentar juntar dos piezas de un rompecabezas que parecen no encajar: eso es lo que los físicos están tratando de hacer. Cada avance nos acerca un poco más a comprender los misterios del universo, pero también nos recuerda lo poco que realmente sabemos.
La historia del modelo atómico es un testimonio de la curiosidad humana y el deseo de entender el mundo que nos rodea. Desde las ideas simples de Dalton hasta la complejidad de la mecánica cuántica, cada teoría ha sido un paso hacia adelante en nuestra búsqueda de conocimiento. ¿Qué nos depara el futuro? Quizás nuevas tecnologías o descubrimientos que cambien nuestra comprensión de la materia. Una cosa es segura: la historia del átomo está lejos de haber terminado.
¿Qué es un átomo?
Un átomo es la unidad básica de la materia, compuesta por un núcleo central que contiene protones y neutrones, rodeado por electrones que orbitan en diferentes niveles de energía.
¿Quién fue el primero en proponer la teoría atómica?
John Dalton fue el primero en proponer la teoría atómica moderna en 1803, sugiriendo que los átomos son las unidades fundamentales de la materia.
¿Qué es la mecánica cuántica?
La mecánica cuántica es una rama de la física que describe el comportamiento de las partículas subatómicas, donde los principios de la probabilidad y la incertidumbre juegan un papel crucial.
¿Cómo se relaciona el modelo atómico con la química?
El modelo atómico es fundamental para la química, ya que explica cómo los átomos se combinan para formar moléculas y cómo interactúan entre sí en reacciones químicas.
¿Qué es el Modelo Estándar?
El Modelo Estándar es una teoría en física que describe las partículas fundamentales y las fuerzas que actúan entre ellas, unificando muchos conceptos de la física moderna.