La teoría atómica ha recorrido un largo camino desde sus inicios hasta convertirse en una de las bases fundamentales de la química moderna. A lo largo de la historia, diferentes científicos han propuesto modelos que han desafiado y enriquecido nuestra comprensión del átomo. Desde la idea inicial de Demócrito sobre la indivisibilidad de la materia hasta el complejo modelo cuántico actual, cada avance ha aportado una pieza valiosa al rompecabezas de la estructura atómica. En este artículo, exploraremos los hitos más significativos en la evolución de la teoría atómica, analizando cómo cada modelo ha contribuido a la comprensión de la materia y cómo, en última instancia, todos ellos han sido cruciales para la ciencia tal como la conocemos hoy.
La Importancia de los Modelos Atómicos en la Ciencia Moderna
El Comienzo de la Teoría Atómica
Para entender la evolución de la teoría atómica, debemos retroceder hasta el siglo V a.C., cuando el filósofo griego Demócrito propuso que la materia estaba compuesta por partículas indivisibles que llamó «átomos». Aunque su idea no tenía base científica en ese momento, sentó las bases para el pensamiento científico posterior. ¿Te imaginas cómo sería el mundo si no tuviéramos esa chispa de curiosidad? La noción de que todo lo que vemos está compuesto por pequeñas partículas invisibles es una idea fascinante que ha inspirado a generaciones de científicos.
El Modelo de Dalton: Un Enfoque Científico
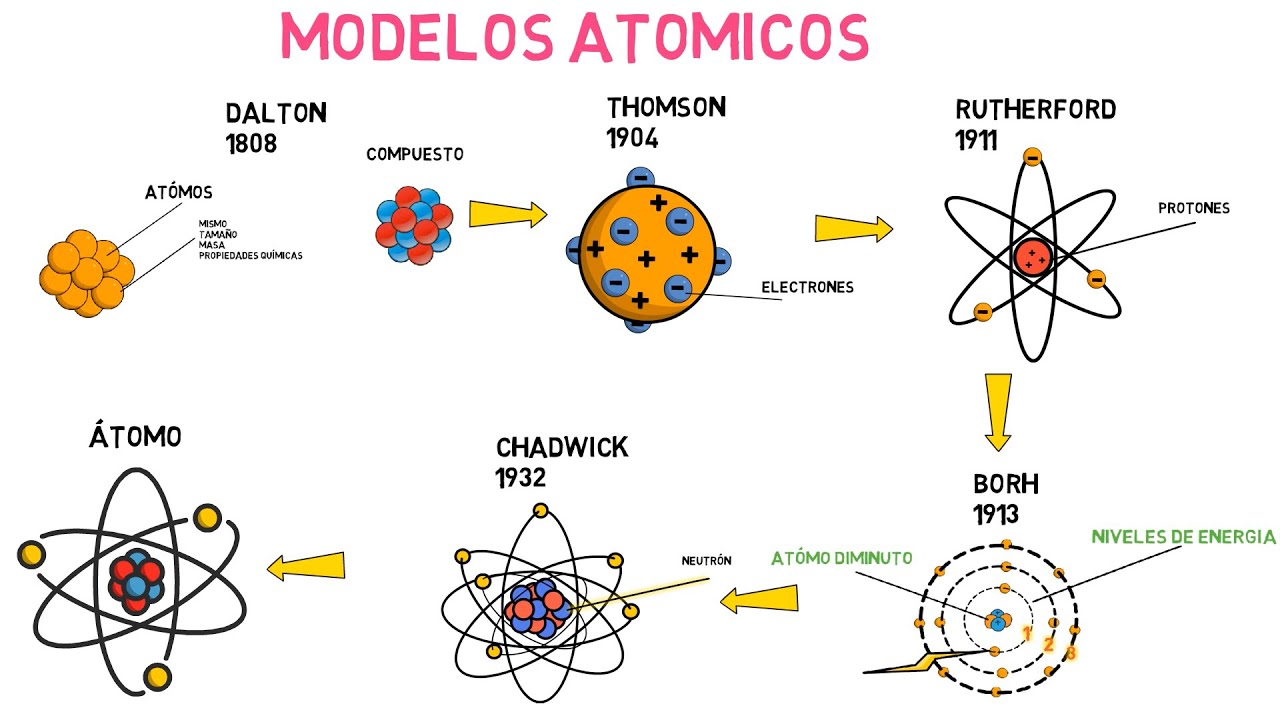
Avancemos unos siglos y llegamos a John Dalton, quien en el siglo XIX formalizó la teoría atómica con un enfoque más científico. Dalton propuso que los átomos son esferas sólidas e indivisibles, cada uno con su propio peso y características. Imagina que cada átomo es como una canica de diferentes colores y tamaños; cada una representa un elemento distinto. Esta analogía nos ayuda a visualizar cómo los átomos se combinan para formar compuestos. La teoría de Dalton fue un gran avance porque introdujo la idea de que los átomos podían unirse en proporciones definidas para formar moléculas, algo que revolucionó la química.
Limitaciones del Modelo de Dalton
Sin embargo, el modelo de Dalton no estaba exento de limitaciones. Por ejemplo, no podía explicar la existencia de isótopos, que son átomos del mismo elemento con diferentes masas. ¿Te has preguntado alguna vez por qué algunos elementos tienen variantes? Esto fue un indicativo de que la teoría necesitaba ser ajustada. A medida que la ciencia avanzaba, nuevas investigaciones comenzaron a cuestionar la idea de que los átomos eran completamente indivisibles.
El Descubrimiento del Electrón
En el siglo XIX, J.J. Thomson realizó experimentos con tubos de rayos catódicos y descubrió el electrón, una partícula subatómica con carga negativa. Este hallazgo fue como encontrar una pieza del rompecabezas que encajaba perfectamente. Thomson propuso el modelo «pudín de pasas», donde los electrones estaban incrustados en una esfera de carga positiva, similar a las pasas en un pudín. Aunque esta idea fue innovadora, no explicaba del todo la estructura atómica, y pronto surgirían nuevas teorías que llevarían la ciencia a otro nivel.
El Modelo de Rutherford: La Estructura Nucelar
En 1911, Ernest Rutherford llevó a cabo su famoso experimento de la lámina de oro, donde bombardeó una delgada lámina de oro con partículas alfa. Los resultados sorprendieron a todos: la mayoría de las partículas atravesaron la lámina, pero algunas fueron desviadas en ángulos inesperados. Esto llevó a Rutherford a proponer un nuevo modelo atómico, donde la mayor parte de la masa del átomo se concentraba en un núcleo pequeño y denso, rodeado por electrones que giraban a su alrededor. Imagínate un pequeño sol en el centro de un sistema solar; esa es la imagen que debemos tener en mente.
La Revolución Cuántica y el Modelo de Bohr
Sin embargo, el modelo de Rutherford no podía explicar por qué los electrones no colapsaban en el núcleo debido a la atracción electromagnética. Aquí es donde entra Niels Bohr, quien, inspirado por la física cuántica, propuso un modelo en 1913 que introducía niveles de energía cuantizados para los electrones. Bohr imaginó que los electrones orbitaban el núcleo en niveles específicos, como planetas alrededor del sol. Esto fue un gran avance porque, por primera vez, se introdujo la idea de que los electrones podían existir en estados energéticos definidos. Pero, como todo en la ciencia, este modelo también tenía sus limitaciones.
El Modelo Cuántico: La Complejidad del Átomo
A medida que la física cuántica se desarrollaba, se hizo evidente que el modelo de Bohr no podía explicar completamente el comportamiento de los electrones. En la década de 1920, científicos como Werner Heisenberg y Erwin Schrödinger desarrollaron el modelo cuántico, que describe a los electrones no como partículas en órbitas fijas, sino como nubes de probabilidad. En lugar de imaginar electrones girando en caminos definidos, ahora debemos pensar en ellos como sombras que se mueven en un espacio tridimensional. Esta idea es tanto fascinante como desconcertante. ¿Cómo podemos entender algo que no podemos ver? La física cuántica desafía nuestra intuición y nos lleva a un mundo donde las reglas son completamente diferentes.
La Aplicación de la Teoría Atómica en la Vida Cotidiana
Ahora que hemos recorrido la evolución de la teoría atómica, es interesante reflexionar sobre cómo estos conceptos se aplican en nuestra vida diaria. Desde la medicina hasta la tecnología, la comprensión de la estructura atómica ha permitido avances inimaginables. Por ejemplo, los tratamientos de radioterapia en cáncer se basan en la interacción de radiaciones con átomos y moléculas en nuestro cuerpo. Asimismo, la tecnología de los semiconductores, que es la base de nuestros dispositivos electrónicos, también se deriva de la comprensión de los electrones y su comportamiento.
La Ciencia en la Educación
La educación también se ha beneficiado enormemente de la teoría atómica. Los conceptos básicos que aprendemos en la escuela, como la tabla periódica, están intrínsecamente ligados a nuestra comprensión de los átomos y sus interacciones. ¿Alguna vez te has preguntado por qué ciertos elementos reaccionan de manera diferente? Todo se reduce a la estructura atómica y cómo los electrones se organizan y se comportan. Esto hace que la química no solo sea una materia escolar, sino una ventana a la comprensión del universo.
La evolución de la teoría atómica es un testimonio de la curiosidad humana y nuestra búsqueda de conocimiento. Cada modelo, desde Demócrito hasta el modelo cuántico, ha sido un paso hacia una comprensión más profunda de la materia y su comportamiento. A medida que la ciencia avanza, es probable que sigamos descubriendo nuevos aspectos de los átomos que aún no podemos imaginar. La historia de la teoría atómica es, en última instancia, la historia de nuestra búsqueda incesante por entender el mundo que nos rodea.
¿Qué es un átomo?
Un átomo es la unidad básica de la materia, compuesta por un núcleo central que contiene protones y neutrones, rodeado por electrones que orbitan en diferentes niveles de energía.
¿Cuál es el modelo atómico más aceptado hoy en día?
El modelo cuántico es el más aceptado en la actualidad, ya que describe el comportamiento de los electrones como nubes de probabilidad en lugar de trayectorias fijas.
¿Por qué es importante la teoría atómica en la química?
La teoría atómica es fundamental en la química porque explica cómo los átomos interactúan entre sí para formar moléculas y compuestos, lo que a su vez afecta todas las reacciones químicas que ocurren en la naturaleza.
¿Cómo ha cambiado la teoría atómica a lo largo del tiempo?
La teoría atómica ha evolucionado desde la idea de átomos indivisibles de Demócrito, pasando por los modelos de Dalton, Thomson, Rutherford y Bohr, hasta llegar al modelo cuántico, que considera la naturaleza probabilística de los electrones.
¿Qué aplicaciones tiene la teoría atómica en la vida cotidiana?
La teoría atómica tiene múltiples aplicaciones, incluyendo la medicina (radioterapia), la tecnología (semiconductores) y la educación, facilitando la comprensión de fenómenos químicos y físicos en nuestra vida diaria.
Este artículo abarca los aspectos fundamentales de la evolución de la teoría atómica, con un enfoque en su relevancia y aplicaciones en la vida cotidiana, y utiliza un lenguaje accesible y atractivo para el lector.