¿Alguna vez te has preguntado qué es lo que realmente compone la materia? ¡Los átomos! Son los bloques de construcción de todo lo que nos rodea, desde el aire que respiramos hasta el agua que bebemos. A lo largo de la historia, la comprensión de la estructura atómica ha evolucionado, dando lugar a varios modelos que intentan explicar cómo están organizados y funcionan estos diminutos componentes. En este artículo, haremos un recorrido por los diferentes modelos atómicos, desde el más simple hasta el más complejo, explorando cómo cada uno ha contribuido a nuestra comprensión actual de la química y la física. Así que, siéntate, relájate y acompáñame en este viaje atómico.
El Modelo de Dalton: La Teoría de los Átomos
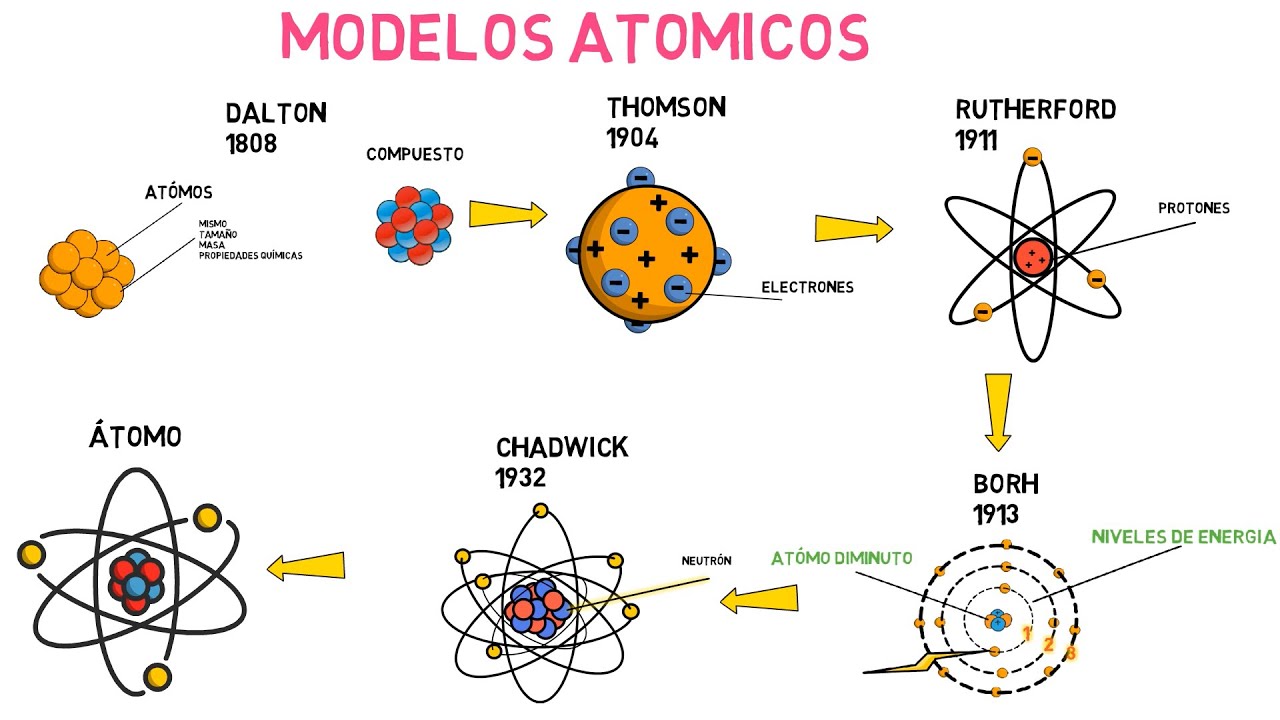
Empecemos con el primer modelo atómico que realmente dio un paso significativo en la comprensión de la materia: el modelo de John Dalton, que data de principios del siglo XIX. Dalton propuso que todos los elementos están compuestos por átomos, que son indivisibles y homogéneos. Imagina que los átomos son como pequeñas canicas que no se pueden dividir. Según él, los átomos de un mismo elemento son idénticos en masa y propiedades, mientras que los átomos de diferentes elementos tienen masas diferentes. Este modelo fue fundamental porque sentó las bases para la química moderna y ayudó a entender que los compuestos se forman cuando los átomos de diferentes elementos se combinan en proporciones fijas.
Limitaciones del Modelo de Dalton
Aunque el modelo de Dalton fue revolucionario, no estaba exento de limitaciones. No explicaba fenómenos como la electricidad o el magnetismo en relación con los átomos. Además, más tarde se descubrió que los átomos sí son divisibles, ya que están compuestos por partículas subatómicas como electrones, protones y neutrones. Sin embargo, el modelo de Dalton fue un primer paso crucial en el camino hacia una comprensión más profunda de la estructura atómica.
El Modelo de Thomson: La «Pudín de Ciruelas»
Avancemos un poco más en el tiempo y lleguemos al modelo de J.J. Thomson, que apareció a finales del siglo XIX. Después de descubrir el electrón, Thomson propuso que los átomos no eran esferas sólidas e indivisibles, sino que tenían una estructura más compleja. Imagina un pudín de ciruelas, donde las ciruelas son electrones incrustados en una masa positiva. Este modelo, conocido como el «modelo del pudín de ciruelas», sugería que los electrones estaban distribuidos uniformemente dentro de una esfera de carga positiva. Aunque esta idea era intrigante, pronto se encontró que no explicaba completamente la estructura del átomo.
Los Experimentos de Rutherford
El modelo de Thomson fue desafiado por los experimentos de Ernest Rutherford en 1909. Al bombardear una delgada lámina de oro con partículas alfa, Rutherford observó que algunas de estas partículas se desviaban en ángulos inesperados. Esto llevó a la conclusión de que la mayor parte de la masa del átomo estaba concentrada en un núcleo pequeño y denso, lo que llevó a la creación del siguiente modelo atómico.
El Modelo de Rutherford: El Núcleo Atómico
Con el descubrimiento del núcleo, Rutherford presentó su modelo en 1911. En este modelo, el átomo se asemeja a un sistema solar, donde los electrones giran alrededor de un núcleo central, que contiene protones y neutrones. Este modelo fue un gran avance porque introdujo la idea de que el átomo tiene una estructura interna, donde la mayor parte de su masa se encuentra en el núcleo. Sin embargo, había un problema: según las leyes de la física, los electrones en movimiento alrededor del núcleo deberían perder energía y caer en él, lo que no sucedía. Así que, aunque fue un gran paso adelante, el modelo de Rutherford no podía explicar la estabilidad del átomo.
El Modelo de Bohr: Niveles de Energía
La solución a este dilema llegó con Niels Bohr en 1913. Bohr propuso que los electrones se mueven en órbitas fijas alrededor del núcleo, pero solo en ciertos niveles de energía permitidos. Imagina un tren que solo puede viajar en rieles específicos; no puede detenerse en cualquier parte. Este modelo ayudó a explicar por qué los electrones no se caen en el núcleo, ya que solo pueden existir en esas órbitas específicas. Además, Bohr introdujo la idea de que los electrones pueden saltar entre estos niveles de energía, absorbiendo o emitiendo fotones de luz. Esto fue fundamental para entender la espectroscopía y cómo los átomos emiten o absorben luz.
El Modelo Cuántico: La Dualidad de Partícula y Onda
A medida que la física cuántica comenzó a desarrollarse en la primera mitad del siglo XX, se hizo evidente que el modelo de Bohr tenía sus limitaciones. El modelo cuántico, basado en las ideas de científicos como Schrödinger y Heisenberg, cambió radicalmente nuestra comprensión del átomo. En lugar de pensar en los electrones como partículas que se mueven en órbitas fijas, el modelo cuántico describe a los electrones como ondas de probabilidad. Imagina que, en lugar de saber exactamente dónde está un electron, solo puedes calcular la probabilidad de encontrarlo en una determinada región del espacio. Esto es como tratar de encontrar a un gato en una habitación oscura; puedes tener una idea de dónde podría estar, pero no puedes verlo claramente.
Los Orbitales Atómicos
En el modelo cuántico, los electrones no ocupan órbitas definidas, sino que se distribuyen en lo que se llama «orbitales». Estos son espacios tridimensionales donde es más probable encontrar un electrón. Existen diferentes tipos de orbitales (s, p, d, f), cada uno con su propia forma y energía. Esta descripción probabilística del comportamiento electrónico ha permitido a los científicos comprender mejor la química y la formación de enlaces entre átomos, ya que la disposición de los electrones en los orbitales es crucial para la reactividad química.
Desde el modelo de Dalton hasta el modelo cuántico, la comprensión de la estructura atómica ha recorrido un largo camino. Cada modelo ha aportado su granito de arena, corrigiendo y expandiendo lo que sabemos sobre los átomos. Si bien todavía hay mucho que aprender, estos modelos nos han permitido desarrollar tecnologías modernas, desde la electrónica hasta la medicina. Así que, la próxima vez que mires a tu alrededor, recuerda que todo lo que ves está hecho de átomos, cada uno con una historia fascinante que contar.
¿Por qué los modelos atómicos son importantes?
Los modelos atómicos son fundamentales porque nos ayudan a entender la estructura y el comportamiento de la materia. Sin ellos, no tendríamos una base sólida para la química y la física moderna.
¿Cuál es el modelo atómico más aceptado hoy en día?
El modelo cuántico es el más aceptado en la actualidad, ya que describe de manera precisa el comportamiento de los electrones y su interacción con el núcleo.
¿Qué papel juega el núcleo en la estabilidad del átomo?
El núcleo, que contiene protones y neutrones, es crucial para la estabilidad del átomo. La fuerza nuclear mantiene unidos a los protones y neutrones, mientras que la repulsión eléctrica entre los protones se contrarresta por esta fuerza.
¿Por qué los electrones no colapsan en el núcleo?
Los electrones no colapsan en el núcleo porque ocupan niveles de energía específicos y se comportan como ondas de probabilidad, lo que les impide caer en el núcleo.
¿Cómo influyen los modelos atómicos en la tecnología actual?
Los modelos atómicos han permitido avances en diversas tecnologías, como la electrónica, la energía nuclear y la medicina, al proporcionar una comprensión profunda de cómo interactúan los átomos y las moléculas.